分子医学部門
Division of Molecular Medicine
| 分野の特色 |
|
遺伝子や蛋白がどのように機能しているのかを理解することによって、難治疾患に対する治療法や診断法の開発を目指します。そして、基礎研究の成果として創出した新しい治療法や診断法を臨床現場へ橋渡しするためのトランスレーショナルリサーチを推進します。 |
| 分野での主要な研究テーマとその取り組みについての説明 |
|
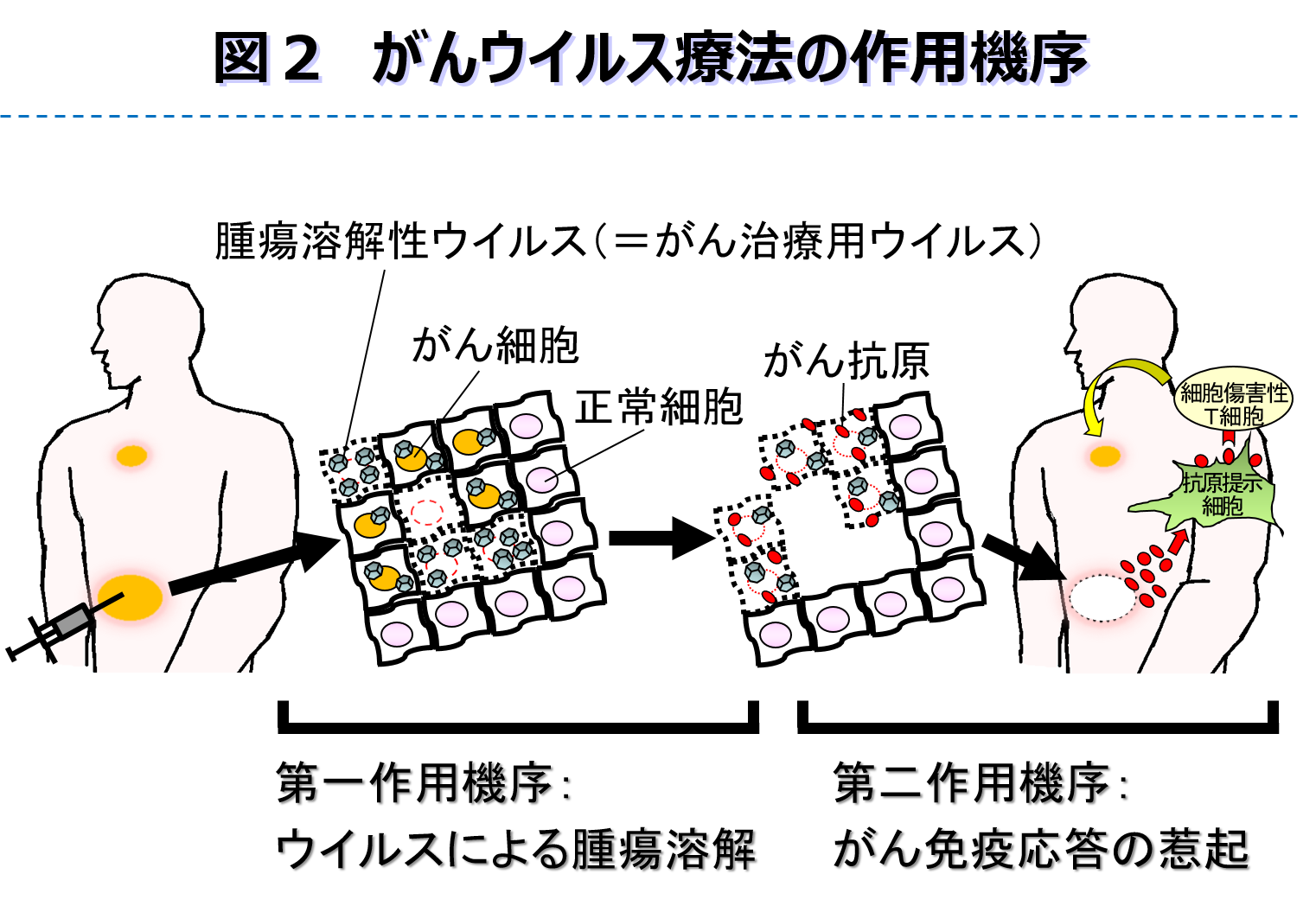
従来の手術、抗がん剤や放射線の標準療法に抵抗性を示す難治性悪性腫瘍に対して、新しい治療法の開発が望まれている。その一つとして期待されているがんウイルス療法は、感染した細胞内で増殖伝播しながらそれらを溶解死滅させるウイルス本来の性質をがん治療に利用する方法であり(図1)、様々な作用機序によって腫瘍を攻撃できる利点がある。第一にウイルスが感染したがん細胞・組織内で増殖伝播することによって直接腫瘍を溶解する。第二にそれに伴って抗腫瘍免疫が賦活化され全身に治療効果を発揮する(図2)。
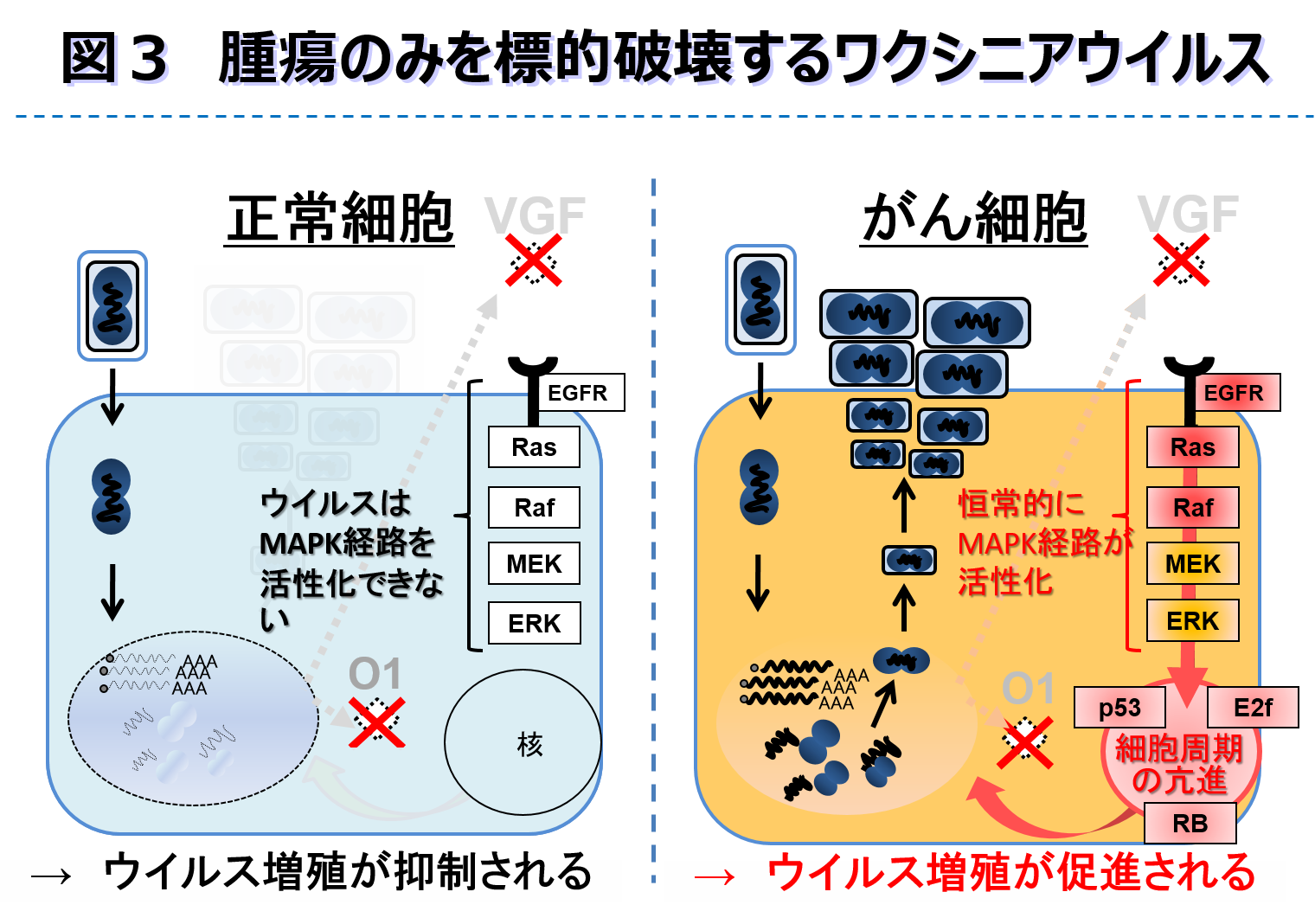
本療法は、1900年代の初めから始まっていたが、当時は野生型に近いウイルスをがん患者に投与していたので、安全性の観点に問題があった。ところが今日、遺伝子工学技術や、ウイルス及びがんの分子病態解析が発展し、ウイルスが元来持っている正常組織に対する病原性を排除し、ウイルスをがん細胞だけで増殖させることが可能になった。(別冊「医学のあゆみ」遺伝子治療の新局面 37-43, 2019)。 我々は、“どのようにウイルスが細胞に感染し増殖するか?”また、“どのようにウイルスが抗腫瘍免疫を賦活化するか?”といった疑問を分子レベルで解明することを起点にして、より安全で効果的ながん治療用ウイルスシーズの創出とトランスレーショナルリサーチを推進するとともに、その実践教育を通して最先端医療の遺伝子治療分野に貢献できる人材を育成することに取り組んでいる。 最近、特に注目しているワクシニアウイルスは、痘瘡ワクチンとして使われていたが、依然正常組織における弱い増殖性を維持しているため、安全性の観点より改良が必要となる。ワクシニアウイルスは、感染初期に発現する2つのウイルス蛋白(VGFとO1)が協調して細胞増殖を促すことにより、ウイルス複製増殖に最適な細胞環境を構築する。本特性よりウイルス遺伝子VGFとO1を欠損させると、感染した正常細胞ではMAPK経路を活性化できず、ウイルス増殖が抑制される。それに対し、多くのがん細胞では本経路におけるEGF受容体、Ras、Rafなどの活性化型変異があるため、これらの制御異常がVGFとO1によるMAPK/ERK経路の活性化機能を補って、ウイルス増殖は促進される(図3、日米欧にて特許取得済)。 ワクシニアウイルスの複製サイクルにおいて、細胞内成熟ウイルス(IMV)と細胞外性被覆ウイルス(EEV)の子孫ウイルスが出現する。EEVはIMVが宿主由来の外膜を鎧のようにまとった構造を持ち、ウイルス由来のほとんどの抗原分子を隠した形態となる。このためEEVはIMVと比べて高い免疫回避能を発揮し、宿主の免疫を逃れながら血中を介して全身に転移したがんに到達できるという可能性を持っている。しかしながら、このEEVの免疫回避能が完全なものではなく、EEV外膜上に提示される数少ないウイルス抗原の一つである膜蛋白B5Rが宿主免疫の標的となり、最終的にEEVは抗B5R抗体+補体によって中和(不活化)される。そこでウイルス増殖蛋白VGFとO1遺伝子を欠失し、かつ宿主免疫の標的となっているB5R内のSCR(Short consensus repeat)ドメインを欠失したΔSCRウイルスを作製し、担がんモデルマウスにて、その腫瘍溶解能を損なうことなくEEVの中和抗体回避能を高めることを実証した(Molecular Therapy Oncolytics 14: 159-171, 2019)。 さらにワクシニアウイルスは、複数の外来遺伝子を搭載発現できるベクターとしても機能する。2種類の免疫賦活化サイトカインIL-12とIL-7を搭載発現することによって、自然免疫と獲得免疫を活性化させ、既存のがん免疫療法で奏功しない腫瘍に対しても、抗腫瘍免疫を賦活化することを担がんモデルマウスにて実証した(Science Translational Medicine 12: eaax7992, 2020)。このがん治療用ウイルスは、大手製薬会社への導出に至り、臨床試験も開始され、その実用化が着実に進んでいる(https://www.med.tottori-u.ac.jp/news/23901.html)。 一方、がん治療用ワクシニアウイルスに対する感受性と耐性細胞を用いたマイクロアレイによる網羅的解析によって、ウイルスによる腫瘍溶解を正に制御するUCA1を同定し、その作用機序を解明した。UCA1は、卵巣癌、肺癌、大腸癌や胃癌など様々ながんで発現が亢進されているLong non-coding RNAであり、既に予後不良マーカーとして報告されている。即ちUCA1はがん治療用ワクシニアウイルスの抗がん効果を予測するバイオマーカーにもなり得る可能性が示された(Molecular Therapy Oncolytics 13: 35–48, 2019)。 |
| スタッフ |
|
准教授 中村貴史 (なかむら たかふみ) taka@tottori-u.ac.jp |
| 電話番号 |
|
TEL 0859-38-6422 |
| 関連リンク |
|
|