マウスにO157等経口感染させた致死性脳症モデルはミューズ (Muse) 細胞によって救済しうる
分野での主要な研究テーマとその取り組みについての説明
鳥取大学医学部細菌学分野 教授の藤井 潤の研究グループと東北大学大学院医学系研究科細胞組織学分野 教授の出澤 真理の研究グループは共同で、腸管出血性大腸菌 O157 等をマウスに経口感染させ、急性脳症を発症したモデルに、多能性幹細胞である Muse 細胞を静脈内投与すると、マウスは生き残った。生き残ったマウスは、四肢麻痺、けいれんなど後遺症は全く認めずに体重減少もなく元気に生き残った。静脈投与された Muse 細胞は脳症を起こしている脳組織に選択的に遊走し炎症を止めるとともに G-CSF 等を産生等して脳神経を再生、自ら脳神経細胞に分化して傷ついて死にゆく神経細胞を置き換えた。脳障害組織に選択的に遊走・生着し機能的な脳神経細胞に自発的に分化することで脳の回復がもたらされ、後遺症もなく3ヶ月以上マウスは生息した。さらに腸管出血性大腸菌 O111 を微調整して NOD-SCID マウスに経口感染させ、経口感染後 48 時間後に Muse 細胞を5万細胞尾静注した結果、マウスは 100%生存することに成功した。
本研究成果は、2019 年 10 月 1 日に Molecular Therapy 誌の Open access 版で発表され、2020 年 1 月号のMolecular Therapy Vol. 28 No 1 January 2020 として正式にプレスされます。また本研究は鳥取大学国際乾燥地研究教育機構 研究プロジェクト推進経費および株式会社ヤクルト本社の支援を受けて行われました。
タイトル
Rescue from Shiga toxin 2-producing Escherichia coli-associated encephalopathy by intravenous injection ofMuse cells in NOD-SCID mice
ホームページ
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(19)30452-6
【背景】
O157 を中心とした腸管出血性大腸菌 (enterohemorrhagic Escherichia coli:EHEC) の多くは、僅か 100 個程度の菌数で感染するため、日本における集団感染は後を絶たない。EHEC 感染症が重症化すると、急性脳症や溶血性尿毒症症候群 (Hemolytic Uremic Syndrome, HUS) を発症する。また、その死因の多くは急性脳症である。2011 年、富山県を中心として焼き肉チェーン店において、ユッケによる EHEC O111 (O111) の集団感染が発生し、181 名が発症した。この O111 はベロ毒素2型のみ産生していたため強毒であり、HUS を発症した患者は 34 例、そのうち急性脳症を発症した患者は 21 例(62%)にもおよんだ。そのうち5名の尊い命が奪わた。2011 年、日本でユッケ事件が起きたので、あまり日本では話題とならなかったが、驚異的な EHEC O104 がヨーロッパと北米を震撼させた。ヨーロッパと北米を含む 16 カ国におよんだの大規模集団感染は、患者数総数 4,075 名、908 名が HUSをきたし、50 名が死亡した。原因食材は、レストランなどで提供された、もやしとされた。この EHEC O104 は凝集付着性大腸菌がファージによってベロ毒素2型を獲得したもので、EHEC O104 の規模は実質、世界最悪規模の集団感染であり、死亡者4名を出した 1996 年の大阪堺市の学校給食を原因とした集団感染の比ではない。
【背景 EHEC の脳症に対する治療と現状】
EHEC 感染症による脳症は予後不良のことが多く,死因の多くを占めるが現時点では確立した治療法はない。EHEC による脳症の治療の基本は,支持療法であり、脳浮腫と発作(痙攣)の治療を目的とした,全身管理と中枢神経症状の治療を行う。呼吸・循環を安定させ,必要に応じ透析療法等で体液異常を補正し、人工呼吸器を使用する。強度なけいれん発作に対する治療として、抗けいれん剤や頭蓋内圧降下療法を行う。ステロイドパルス療法や血漿交換療法は、それらの効果について検討されたものはほとんどが小規模散発事例であり,有効性は明らかではない。
【Muse 細胞】
Multilineage-differentiating stress enduring (Muse)細胞は 2010 年に東北大学の出澤教授らのグループによって発表された生体内に存在する多能性幹細胞です。Muse 細胞は血管に投与するだけで、脳梗塞や心筋梗塞等の障害部位を認識し選択的に集積します。その後、自発的に障害された組織を修復するとともに細胞死によって失われた細胞を補充して後遺症を残さず治療できる。
実験系のプロセス
ヒト Muse 細胞は骨髄間葉系幹細胞から多能性幹細胞のマーカーである SSEA-3 を指標に採取してきた。1994 年、藤井 潤らは、EHEC O157:H- (E32511) ベロ毒素 2c 産生臨床分離株をカナダの研究室から分与され、それを使って EHEC 急性脳症発症マウスモデルを作成した(Fujii Jet al. Infect Immun1994)。EHEC の最小発症菌量は 100 個(CFU)とされているが、このモデルは EHEC 100 億 CFU 感染させた。このマウスモデルを応用して、ユッケ事件において臨床分離されたベロ毒素 2 型産生 EHEC O111 を同様に、ヒトの体重に換算して、最小発症菌量(100 CFU)の 2500 億倍マウスに感染させて実験した。マウスは、ヒト細胞が拒絶されないように、免疫不全マウス(T 細胞 B 細胞欠損 NOD-SCID マウス)を使かった。コントロールとしてミューズ細胞を含まないヒトの骨髄間葉系幹細胞 (non-Muse 細胞: 非 Muse 細胞) を使用した。
実験結果
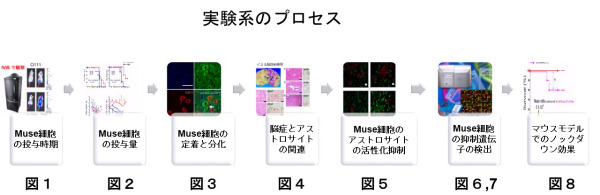
O157 または O111 を 100 億個、NOD-SCID マウスに経口感染させるとマウスは 108 時間内に100%死亡する。そこで図1に示すように、ヒトをどの時期に尾静脈注射(尾静注)すると効果を最大限引き出せるかを調べた。ナノ・ランタンという高輝度化学発光タンパク質でラベルした Muse 細胞を尾静脈から 5 万細胞注射して、体外から Muse細胞の遊走を観察した。その結果、O157 またはO111 経口感染 48 時間に Muse 細胞は脳を含む最大限に拡張して遊走していた(矢印赤)。したがって、O157, O111 モデルには、経口感染後 48 時間に Muse 細胞、5 万細胞を尾静注すれば、障害部に十分遊走して効果を発揮できる。
* (Molecular Therapy Figure 1B E32511 24h Muse は、間違ってたため訂正を要請しました。)
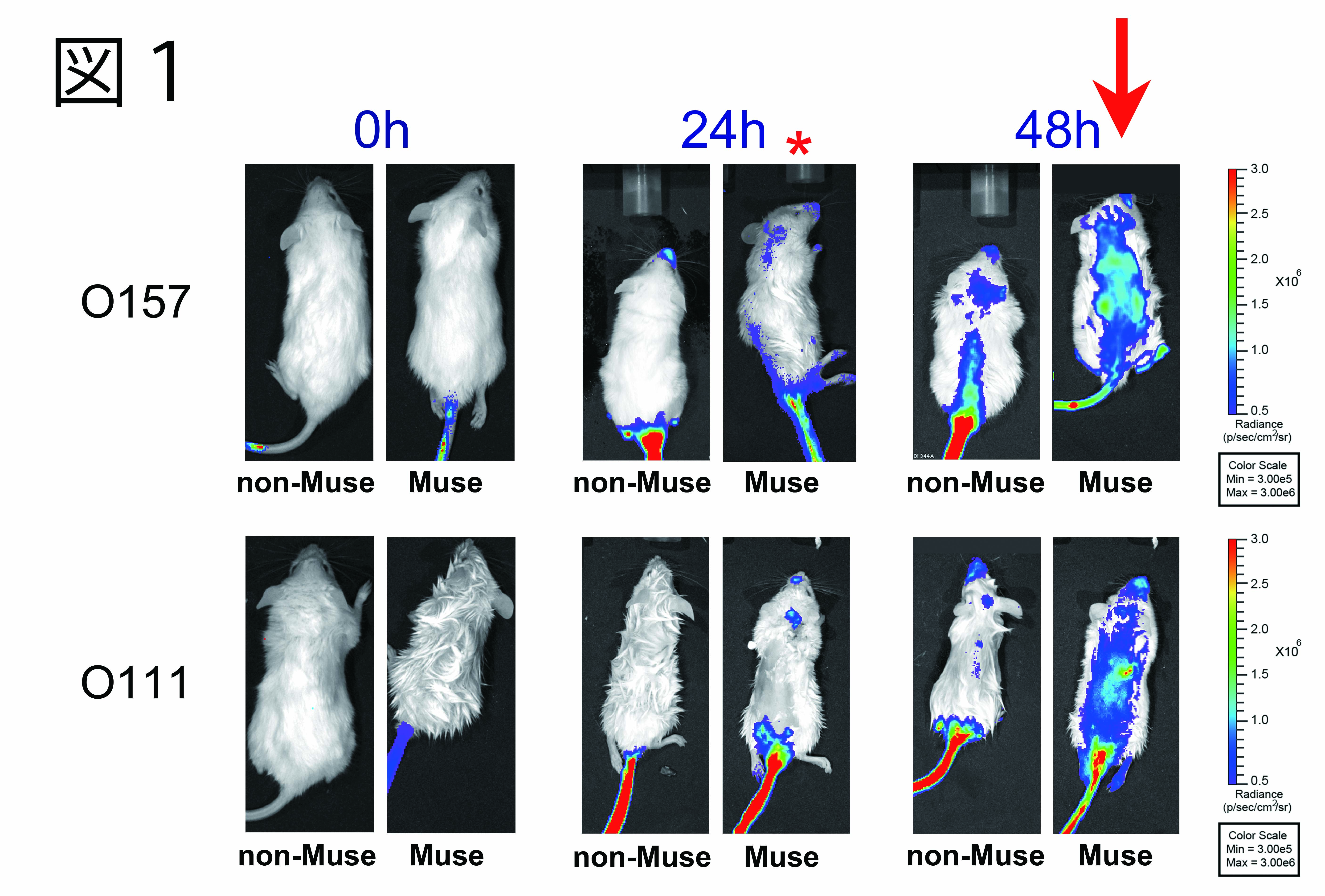
次に図2に示すように、どのくらいヒトMuse 細胞を静注すればよいかよいか確かめる実験を行った。この研究では、ヒト Muse 細胞の効果を明らかにするため、リン酸緩衝塩液(PBS)、ヒト Muse 細胞を含まない骨髄間葉系幹細胞 (non-Muse 細胞; 非 Muse 細胞)の2つのコントロールを用いた。
A) O157 を 10 億個経口感染させ、5 万細胞の Muse 細胞を 48 時間後に静注した結果、Muse 細胞投与群は、非 Muse 細胞投与群、PBS 投与群に比べ、有意に生存期間が延長した。
B) 次に O111 を 10 億個経口させ、感染 48 時間後 Muse 細胞を3万個尾静注したが、Muse 細胞投与群は、非Muse 細胞投与群、PBS 投与群に比べ、有意に生存期間が延長した。
C) O111 を経口感染させ、感染 48 時間後 Muse 細胞を 5 万個尾静注すると、Muse 細胞投与群は、非 Muse 細胞投与群、PBS 投与群に比べ、有意に生存期間が延長すると同時に Muse 細胞投与群が約 33%生存した。なお、PBS 群、非 Muse 細胞群では5日以内に全て死亡した。C の研究を一群 5 匹(Muse. 非 Muse、PBS)で3回繰り返し行った(計 45 匹)。そのうち 5 匹生き残ったマウスを 3 週間、3ヶ月間観察したところ、PBS 群で観察された下肢麻痺、けいれん、脊髄湾曲などの症状は全く見られなかった。
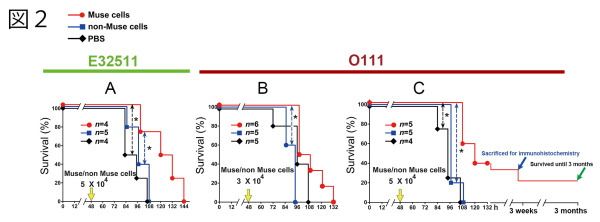
3 ヶ月間生存したマウスの脳を調べたところ、脳内にヒト Muse 細胞が生着しているかヒト細胞を COX IV(Cytochrome c oxidaseIV)で標識して調べた。
その結果、PBS 群の脳障害部位 (A 白枠) において Muse 細胞は生着し (A 下段, B)、神経細胞(β3-tubulin; β3-tub) にまで分化しており、神経突起を構築してマウス神経細胞と接合していた(C 矢印)。
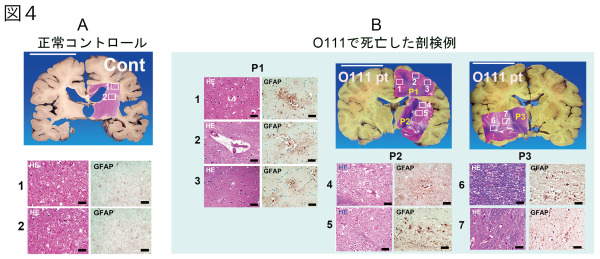
図4 O111に汚染されたユッケを食べて急性脳症で亡くなった1名の患者さんの脳組織を調べた(B)。その結果、脳内のアストロサイトというグリア細胞が活性化されていた(B; P1, P2, P3 の GFAP)。この異変は、2016 年 O157 で汚染されたキュウリを食べて死亡した3名の患者さんの脳組織でも認められた。よって、O157 などの腸管出血性大腸菌による急性脳症を救命するためには、アストロサイトの病的な活性化をくい止める必要がある。
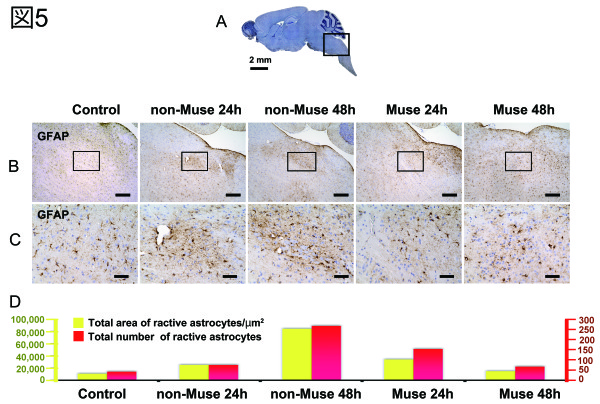
図 5 O111 を経口感染させた NOD-SCID マウスにおいて、脳内のアストロサイトの活性化を免疫染色法で確認し、O111 経口感染 48 時間に Muse 細胞を尾静脈注射すると、アストロサイトの活性化を有意に抑制していることを発見した(図 5 D Muse 48h)。
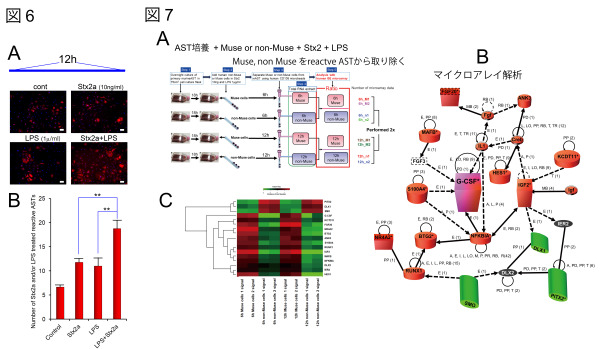
図6 私たちは Muse 細胞の効果を調べるために、培養系でマウスアストロサイト細胞に精製したベロ毒素2型(Stx2)や lipopolysaccharide (LPS)を培養液に加えて、gliosis 状態を引き起こした(A, B)。
図7 この状態のアストロサイトに Muse 細胞と非 Muse 細胞を 6, 12 時間共培養し、再度アストロサイトから分離し、それぞれの細胞での mRNA 発現比をマイクロアレイで解析した (A)。その結果、様々な因子が Muse 細胞では上昇していたが、Muse 細胞は非 Muse 細胞に比べ 14.5 倍、granulocyte-colony-stimulating factor (GCSF)の mRNA 発現が上昇していることに着目した (B, C)。
Muse 細胞は G-CSF 産生することで、その働きを強めていることを検討するために RNA 干渉によって Muse 細胞での産生を抑制した。
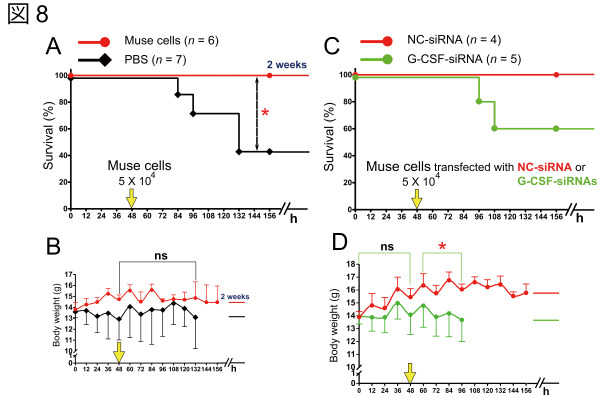
図6(A) NOD-SCIDマウスに 90 億個のO111 を経口感染させ、48 時間後にMuse 細胞を5万個尾静脈すると、マウスが 2 週間 100%生存することを確認した。
(C) 90 億個の O111を経口感染させ、経口感染 48 時間後G-CSF の発現を80%ノックダウンしたMuse 細胞では 40%のマウスが死亡し、また死亡するまでの間の有意な体重減少を認めた。ネガティブコントロール RNAi を導入した Muse 細胞を尾静注したマウスは 100%生存し、体重は増加傾向にあった。
本実験のまとめ
Muse 細胞は
1) ベロ毒素によって障害を受けた場所に血液脳関門を通過して生着し、
2) G-CFS 等を産生して、過剰なアストロサイトの活性を抑制など脳保護作用すると共に、
3) 脳神経細胞に分化して脳機能を再生していると考えられた。
4) その結果、NOD-SCID マウスに O111 を 90 万個経口感染させ、経口感染 48 時間後に 5 万個の Muse 細胞を尾静注すると 2 週間以上 100%生存させることに成功した(Muse 細胞を尾静注しなかったマウスは 60%死亡した)。
共同研究と今後の方針
腸管出血性大腸菌感染症などの感染症モデルを用いた Muse 細胞に関する動物実験の共同研究を展開させていくにあたり、企業等との連携を検討しており、さらに将来には臨床応用への道を探っていく予定です。
最後に
感染症に対しての Muse 細胞を用いた新しい治療法の開発につきまして、随時、新しい知見をこのホームページにてアップします。
来る 11 月 23 日に米子市文化ホール イベントホールにて第 72 回 日本細菌学会 中国・四国支部総会 (https://jsbcs.donotfree.com/) で以下の特別講演を予定しておりますので、その結果につきましても報告させて頂きます。
特別講演
特別講演者 出澤真理教授 東北大学大学院医学系研究科細胞組織学分野
Muse 細胞を用いた医療イノベーションへの挑戦
研究最前線 総会長 藤井 潤 鳥取大学医学部医学科細菌学分野
Muse 細胞を用いた腸管出血性大腸菌 O157 の革命的治療法の開発
企業からの最新報告 木曽 誠一(代表取締役社長) 株式会社 生命科学インスティテュート(三菱ケミカルホールディングス傘下のミューズ細胞製品開発企業)
Muse 細胞製品(CL2020)による修復医療がもたらすパラダイムシフト

