|
1.非代償肝硬変治療薬の開発:肝疾患治療用細胞シート
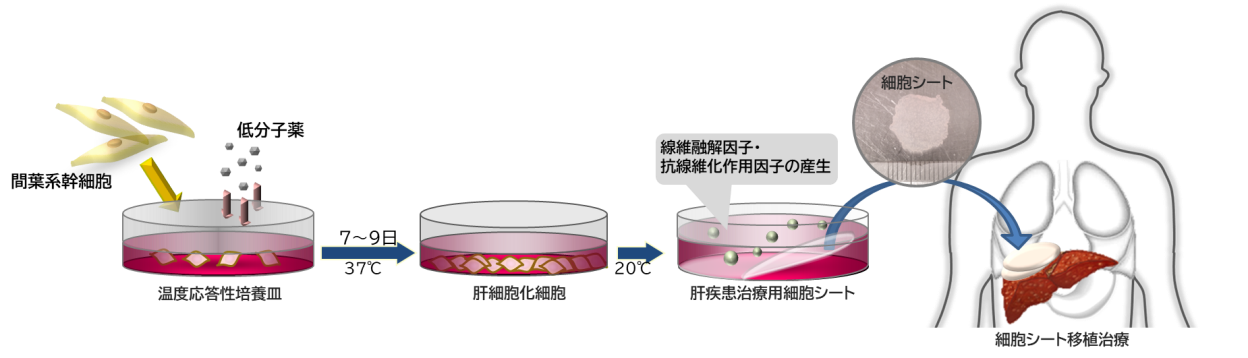
現在、重症肝不全の根治療法は肝移植に限られるが、わが国では十分なドナーを得ることは難しく、幹細胞による肝再生治療法の開発が急務となっています。我々は、幹細胞の中でも、骨髄・脂肪と言った成人の組織中にも存在する間葉系幹細胞に着目し、間葉系幹細胞を利用した新規肝再生治療法の開発に取り組んでいます。この取り組みの中で、ヒト間葉系幹細胞を肝細胞へと分化する際にWnt/β-catenin経路が抑制され、Wnt/β-catenin経路を抑制することで肝細胞への分化が促進されることを明らかにし(1-3)、間葉系幹細胞の肝細胞系譜への分化に有用な低分子化合物を見出しました(4, 5)。また、低分子化合物を利用した分化誘導技術と温度応答性培養皿による細胞シート技術を組み合わせることで、肝疾患治療用細胞シートを開発し、急性肝障害、肝線維化の抑制に有用であることを認めました(5-7)。現在、肝疾患治療用細胞シートを非代償性肝硬変の治療に使用するべく、臨床応用へ向けた取り組みを進めています。
参考文献
1. Am J Physiol Gastrointest Liver physiol 293, 1736-40, 2007
2. Hepatol Res 37,1068-79, 2007
3. Hepatology 48,597-606, 2008
4. Sci Rep 10, 16169, 2015
5. Regen Ther 2, 32-41, 2015
6. Regen Ther 24, 45-57, 2018
7. Sci Rep 9, 6841, 2019
2.臓器線維症の治療薬開発
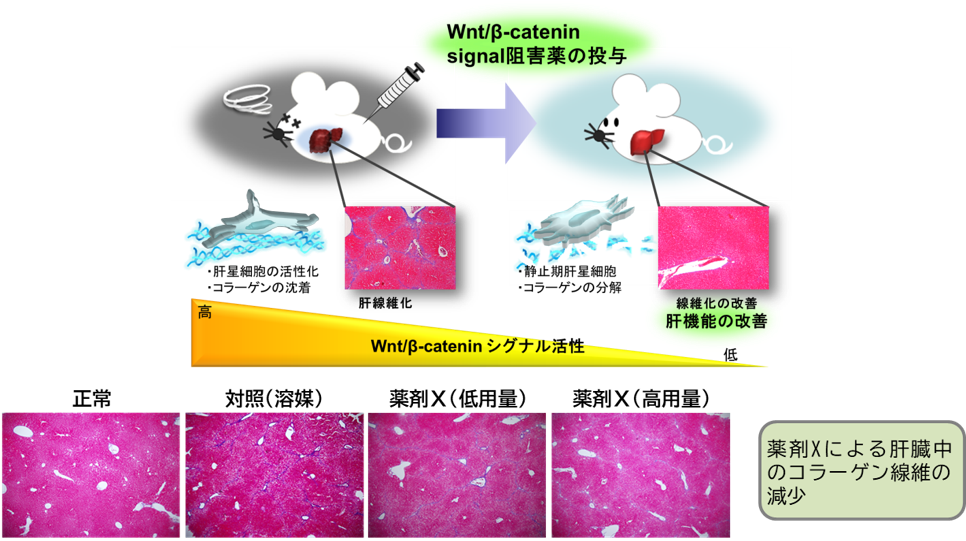
肝硬変をはじめとする臓器線維症は、コラーゲンなどの細胞外マトリックス成分が組織に過剰沈着することで、臓器の機能不全をきたす病態です。線維化の進展には、いずれの臓器においてもTGF-β/Smad経路の亢進が報告されています。しかし、肝硬変、特発性肺線維症、腎線維症などの臓器線維症は未だ治療法のない予後不良の疾患であり、線維化そのものを解消する治療薬の開発が強く望まれています。治療標的としては、近年TGF-β/Smad経路とクロストークするWnt/β-catenin経路が着目されています。我々は、新規Wnt/β-catenin経路阻害剤を複数合成しており(1)、独自に開発したWnt/β-catenin経路阻害剤の中から、臓器線維症に有効な低分子薬のスクリーニングを進めています。これまでに、肝線維症モデルにて線維化を抑制する薬剤を複数見出しており(2,3)、各薬剤の線維化抑制機序の解明や他の臓器線維症への研究展開を進めています。
参考文献
1. Regen Ther 2, 32-41, 2015
2. Yonago Acta Med 63, 79-87, 2020
3. Clin Exp Pharmacol Physiol 2020 Feb 3[Online ahead of print]
3.HBVによるURI1を介した肝細胞がん悪性化メカニズム
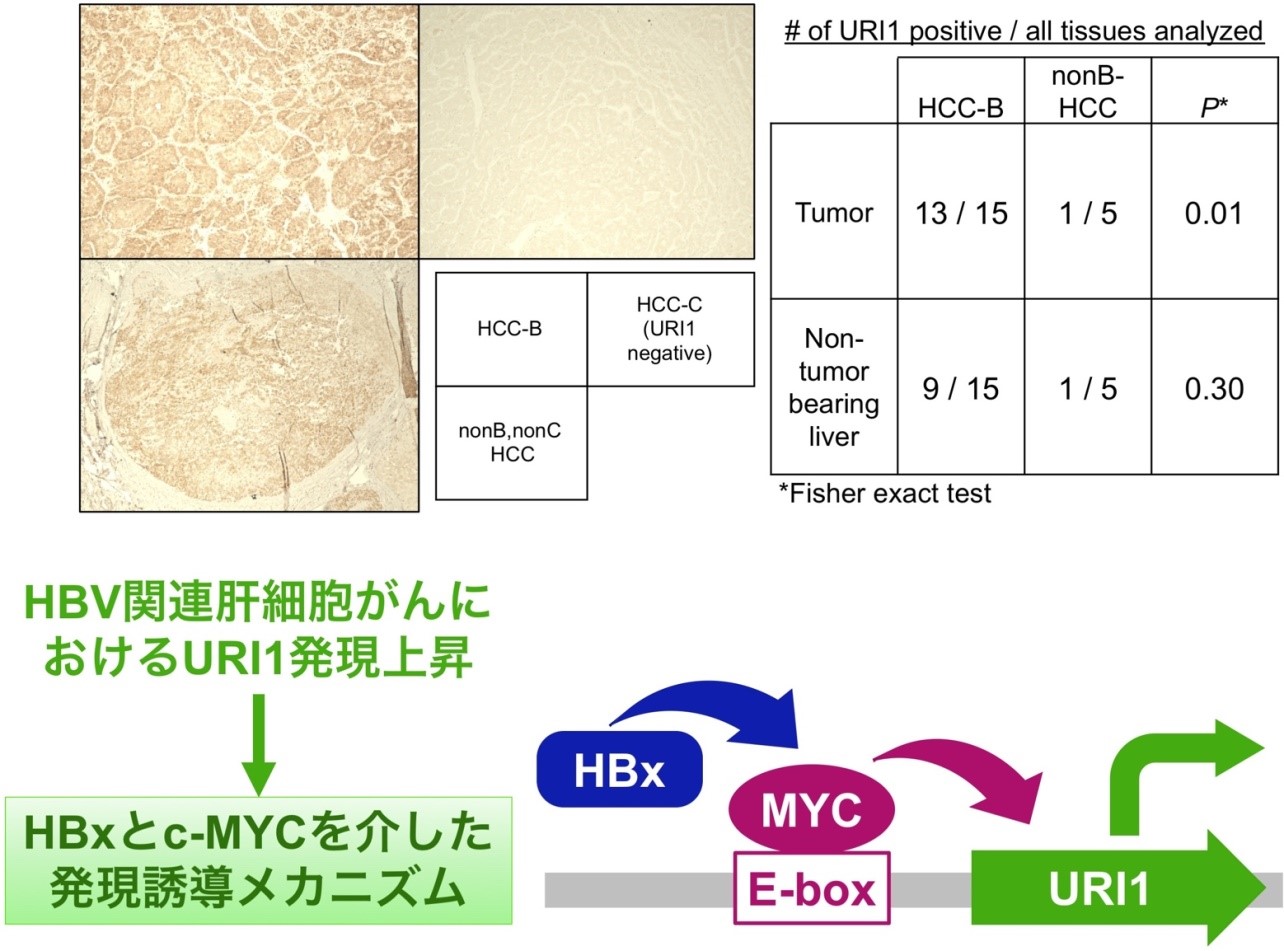
新たな抗ウイルス薬の登場にも関わらず、日本の肝細胞がん患者に占めるHBV既感染者の割合は減少していない。われわれはURI1がHBV関連肝細胞がんで発現亢進しており、そこにHBxとc-MYCが関与していることを明らかにした(Int J Mol Sci 20, 5714, 2019)。本研究ではURI1の機能を解明し、これを標的としたHBV関連肝細胞がんに対する創薬開発を目指している。
4.がん幹細胞を標的とする肝細胞がん治療法
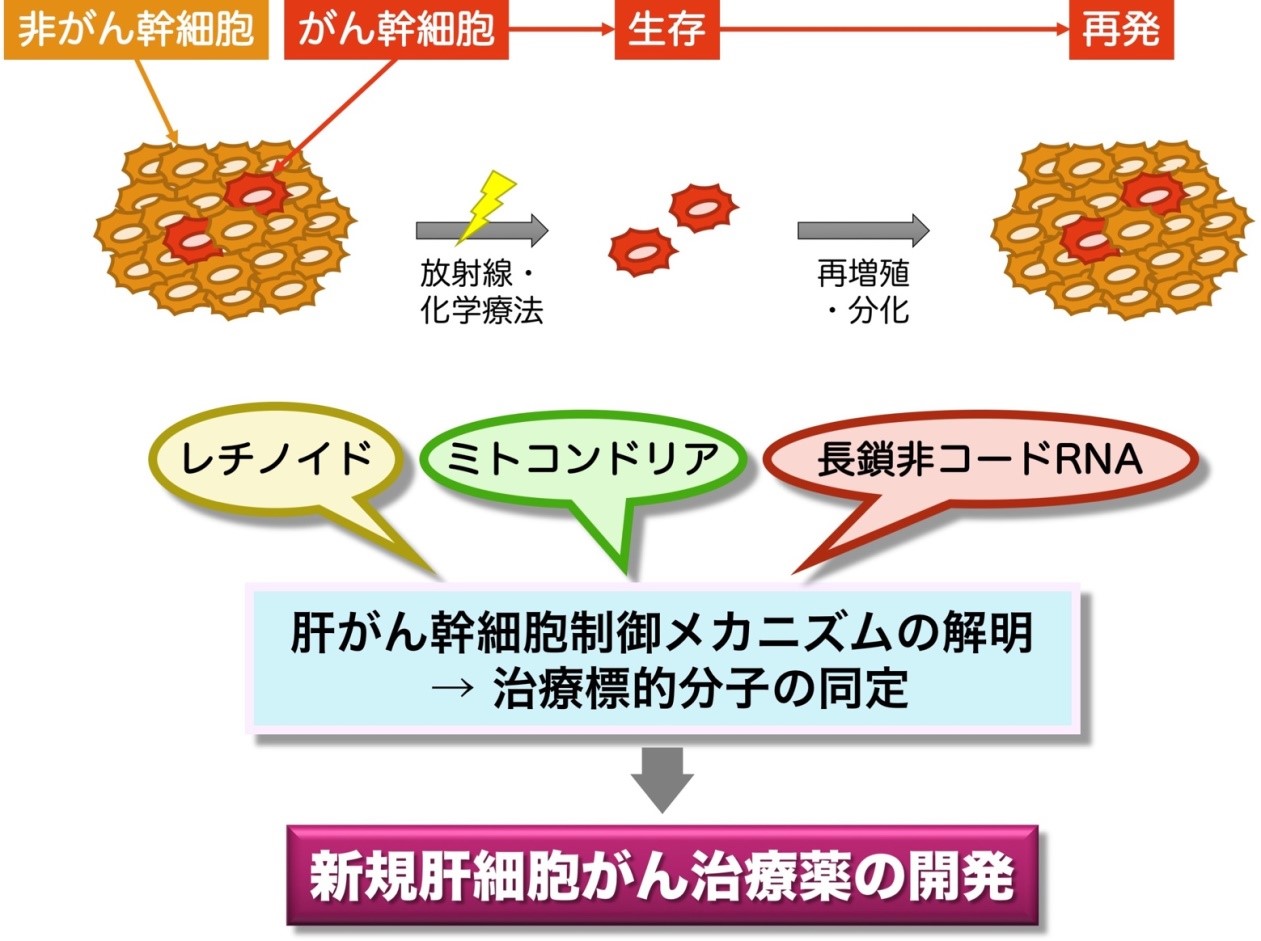
肝細胞がんは、再発率が高く、治療薬が少ないことが知られている。がんの発生、転移、再発には、がん幹細胞の密接な関与が示唆されている。がん幹細胞を効果的に抑制する治療が可能になれば、肝細胞がん患者の予後改善が期待される。われわれはこれまで長鎖非コードRNAであるNEAT1が肝がん幹細胞の制御に関わっていることを明らかにした(Int J Mol Sci. 21, E1927, 2020)。そこで引き続き、下図の3つの観点(レチノイド、ミトコンドリア、長鎖非コードRNA)から、肝がん幹細胞の制御メカニズムについて解明し、新たな治療標的分子の同定と、肝細胞がん治療法の開発を目指している。
|






