生体高次機能学部門
Division of Integrative Bioscience
| 分野名 | ||||||||||||
生体高次機能学分野 Division of Integrative Bioscience 畠グループはこちら→HP 中村グループはこちら→HP | ||||||||||||
| 電話番号 | ||||||||||||
TEL:0859-38-6252 FAX:0859-38-6250 | ||||||||||||
| スタッフの職名と氏名 | ||||||||||||
| ||||||||||||
| 分野の特色 | ||||||||||||
| 末梢・中枢神経系による人体各部のシステム的統合機能や、遺伝子・蛋白質の機能発現に必要な生体内微小環境について、その仕組みや役割を解明し、身体機能の強化や再生を目指します。 | ||||||||||||
| 分野での主要な研究テーマとその取り組みについての説明 | ||||||||||||
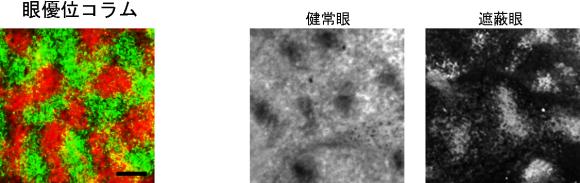
畠教授担当分野→HP  図1:膜融合の制御と遺伝子・再生治療薬への応用 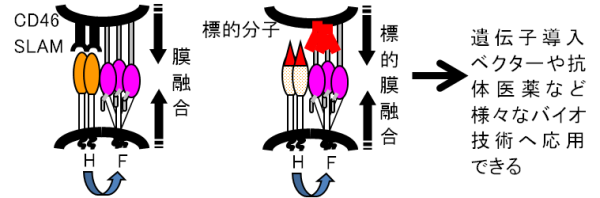 麻疹ウイルスの感染は、H蛋白の細胞レセプター(CD46又はSLAM)への吸着と、それに伴うF蛋白の膜融合によって成立する。H蛋白のレセプターと相互作用するアミノ酸を同定・排除し、かつ新しいトロピズムを加えることによって、膜融合の制御に成功した。 (Nakamura et al., Nature Biotechnology 22: 331-336, 2004 Nakamura et al., Nature Biotechnology 23: 209-214, 2005参照) 図2:ワクシニアウイルスの増殖・病原性の制御と癌標的治療薬への応用 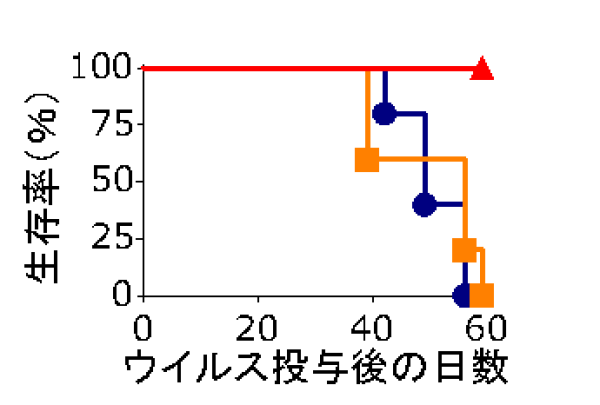 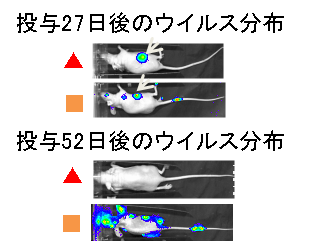 マイクロRNA(miRNA)制御機構による遺伝子発現調節と同調させることによって、ウイルス病原性に関わる膜蛋白B5Rを、癌細胞では発現させる(=ウイルスは増殖する)が、正常細胞ではB5Rを発現させない(=ウイルスは増殖しない)miRNA制御ウイルスを作製した。ヒト膵臓癌細胞の皮下腫瘍マウスモデルにおいて、miRNA制御ウイルス(▲)は、腫瘍(矢印)でのみ増殖し、腫瘍の標的破壊に伴って消失した。生理食塩水(●)は治療効果がなく、無制御ウイルス(■)は腫瘍を破壊したが正常組織でも増殖し、その毒性でマウスは死亡した。 Hikichi et al., Molecular Therapy 19, 1107-1115, 2011参照) | ||||||||||||
| HP作成担当者名 | ||||||||||||
| 畠義郎 mailto:yhata@med.tottori-u.ac.jp |