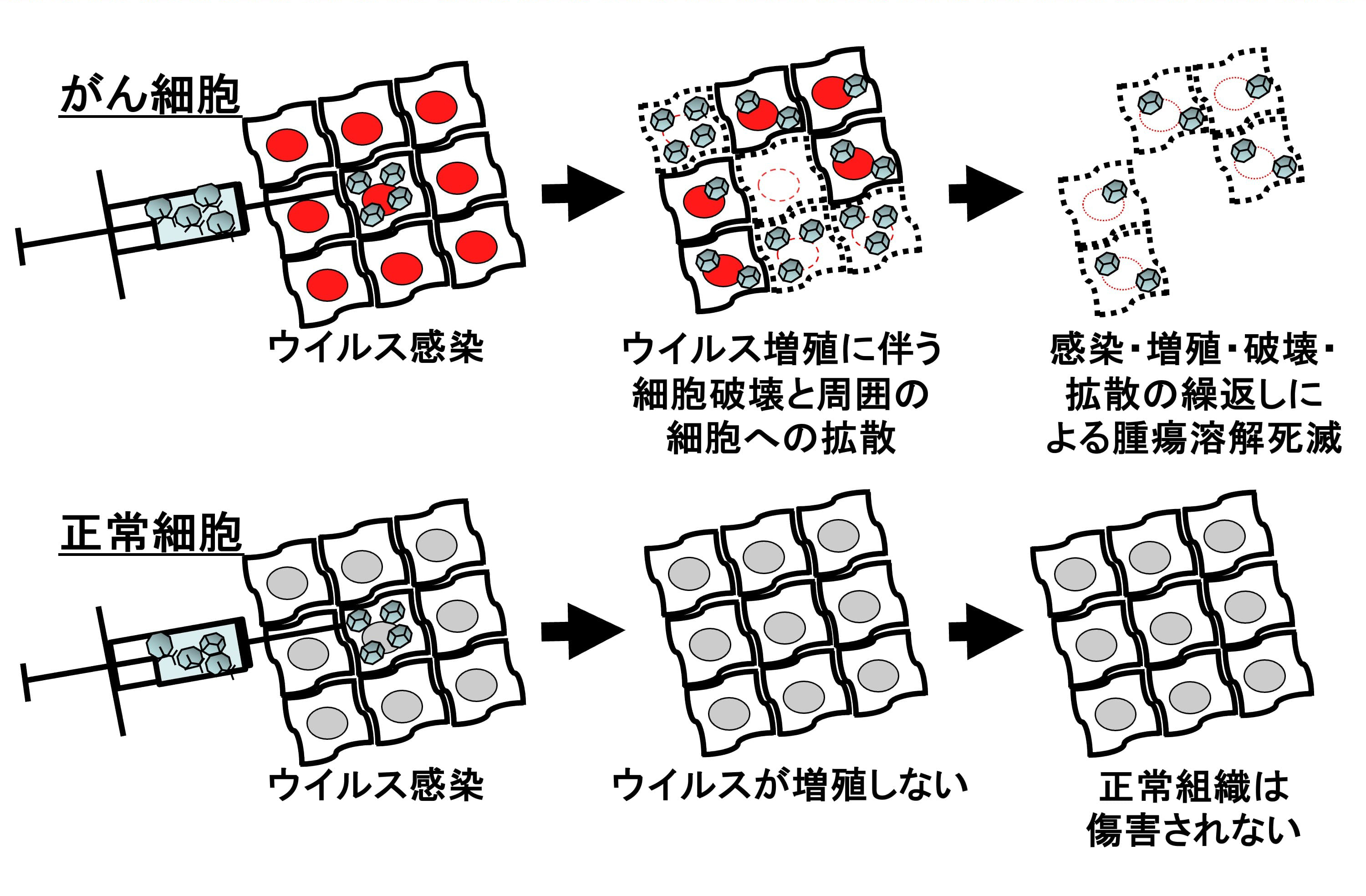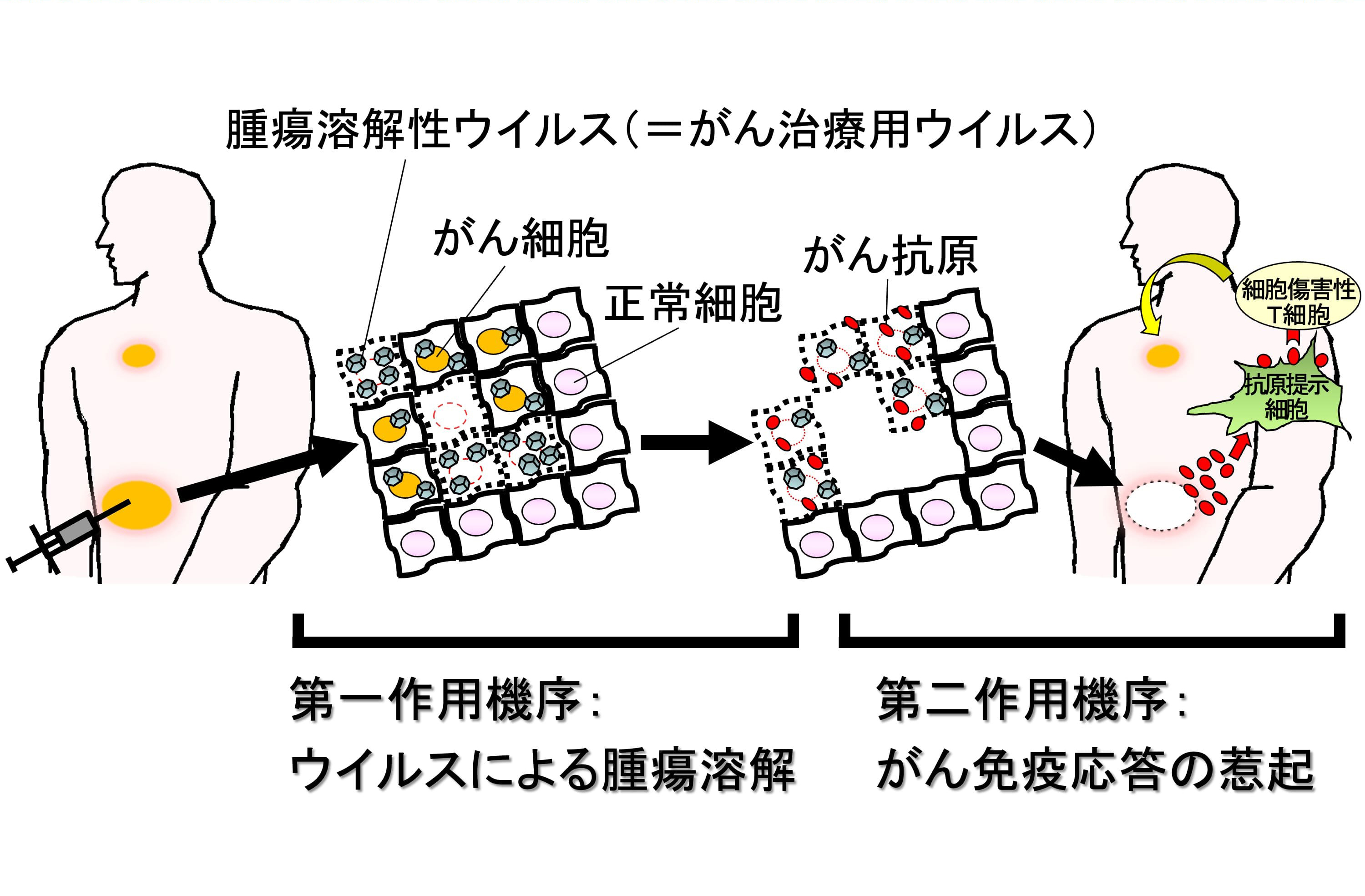
従来の手術、抗がん剤や放射線の標準療法に抵抗性を示す難治性悪性腫瘍に対して、新しい治療法の開発が望まれています。その一つとして期待されているがん遺伝子治療(ウイルス療法)は、感染した細胞内で増殖伝播しながらそれらを溶解死滅させるウイルス本来の性質をがん治療に利用する方法であり(図1)、様々な作用機序によって腫瘍を攻撃できる利点があります。第一にウイルスが感染したがん細胞・組織内で増殖伝播することによって直接腫瘍を溶解します。第二にそれに伴って抗腫瘍免疫が賦活化され全身に治療効果を発揮します(図2)。
本療法は、1900年代の初めから始まっていましたが、当時は野生型に近いウイルスをがん患者に投与していました。その後、遺伝子工学技術の進歩によって、ウイルスが元来持っている正常組織に対する病原性を排除し、ウイルスをがん細胞だけで増殖させる方法が確立されたため、世界中で様々な腫瘍溶解性ウイルスを用いた臨床試験が行われています。(医学のあゆみ 285:370-377, 2023)。
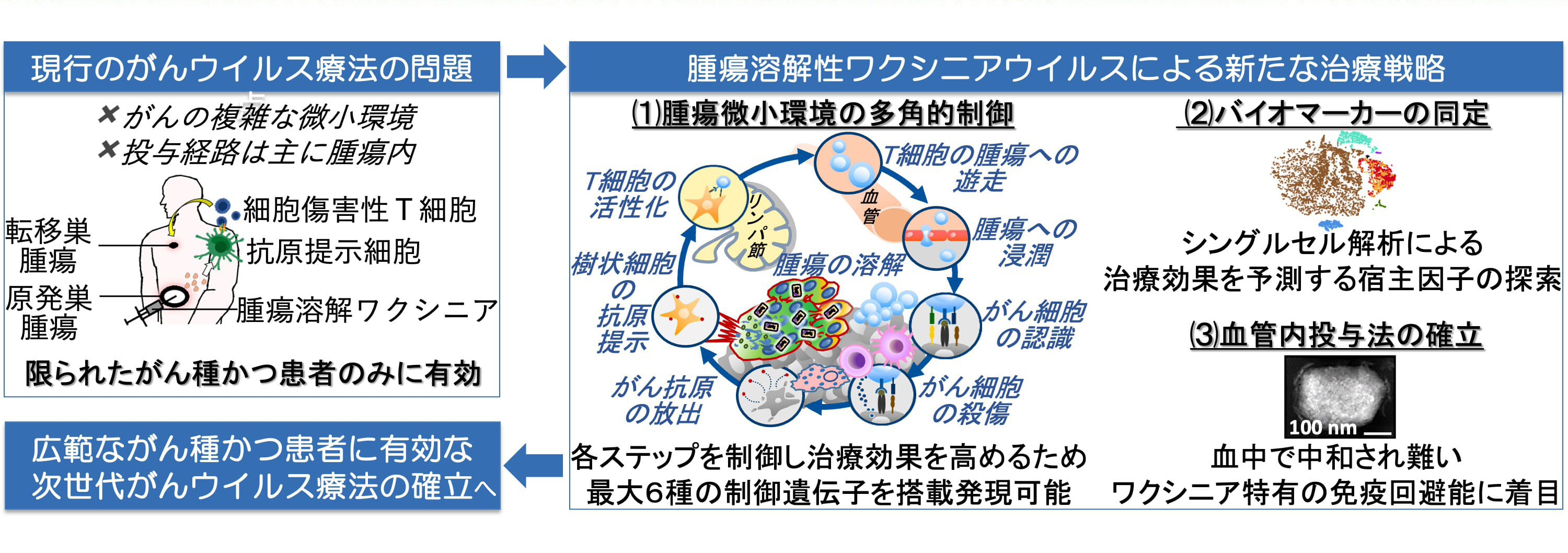
しかしながら、がんは不均質で複雑な微小環境を形成するため、患者ごとにウイルスによる腫瘍溶解や抗腫瘍免疫の賦活化、即ち抗がん効果に差が生じます。又、ウイルス製剤の投与経路は主に腫瘍内であるため、体表にあるがんや超音波・CTガイド下で投与可能ながんに限定されています。そこで我々は、これらの問題を克服すべく、1)がんの複雑な腫瘍微小環境に対抗できる、2)バイオマーカーによって抗がん効果を予想できる、3)腫瘍内投与、または血管内投与、もしくはその併用と最適な投与法を選択できる腫瘍溶解性ワクシニアウイルスによる新たな治療戦略を提案し、広範ながん種かつ患者に有効な次世代がんウイルス療法の確立に取り組んでいます(図3)。
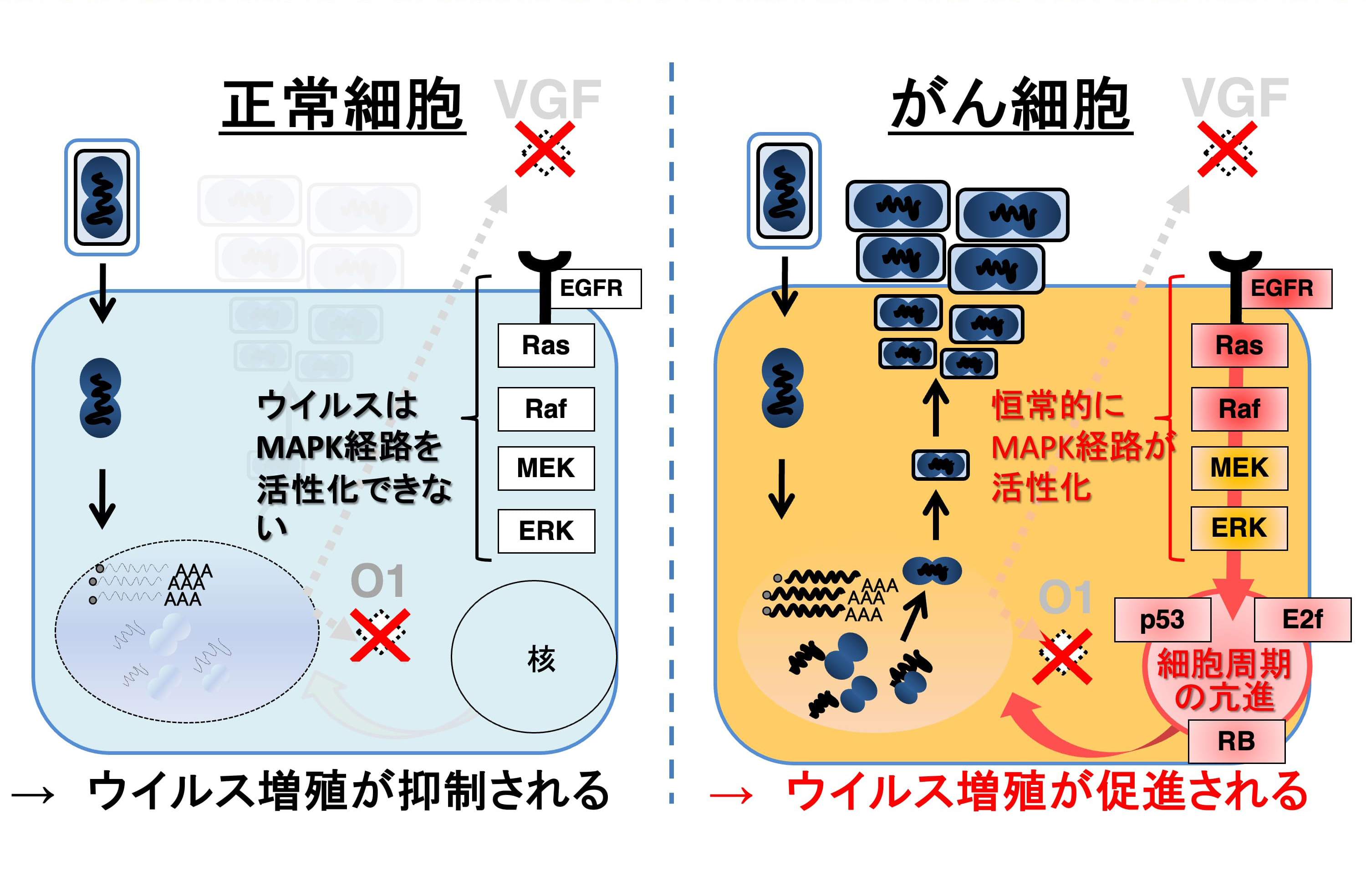
我々が注目しているワクシニアウイルスは、痘瘡ワクチンとして使われていましたが、依然正常組織における弱い増殖性を維持しているため、安全性の観点より改良が必要となります。ワクシニアウイルスは、感染初期に発現する2つのウイルス蛋白(VGFとO1)が協調して細胞増殖を促すことにより、ウイルス複製増殖に最適な細胞環境を構築します。本特性よりウイルス遺伝子VGFとO1を欠損させた遺伝子組換えワクシニアウイルス分裂促進因子活性化タンパク質キナーゼ依存性ワクシニアウイルス(MDRVV:MAPK-Dependent Recombinant Vaccinia Virus)は、感染した正常細胞においてMAPK経路を活性化できず、ウイルス増殖が抑制されます。それに対し、多くのがん細胞では本経路におけるEGF受容体、Ras、Rafなどの活性化型変異があるため、これらの制御異常がVGFとO1によるMAPK/ERK経路の活性化機能を補って、ウイルス増殖は促進されます(図4、Cells 10:985, 2021)。
さらにワクシニアウイルスは、複数の外来遺伝子を搭載発現できるベクターとしても機能します。2種類の免疫賦活化サイトカインIL-12とIL-7を搭載発現することによって、自然免疫と獲得免疫を活性化させ、既存のがん免疫療法で奏功しない腫瘍に対しても、抗腫瘍免疫を賦活化できることを担がんモデルマウスにて実証しました(Science Translational Medicine 12: eaax7992, 2020)。この腫瘍溶解性ワクシニアウイルスは、大手製薬会社への導出に至り、臨床試験も開始され、その実用化が進んでいます(https://www.med.tottori-u.ac.jp/news/23901.html)。
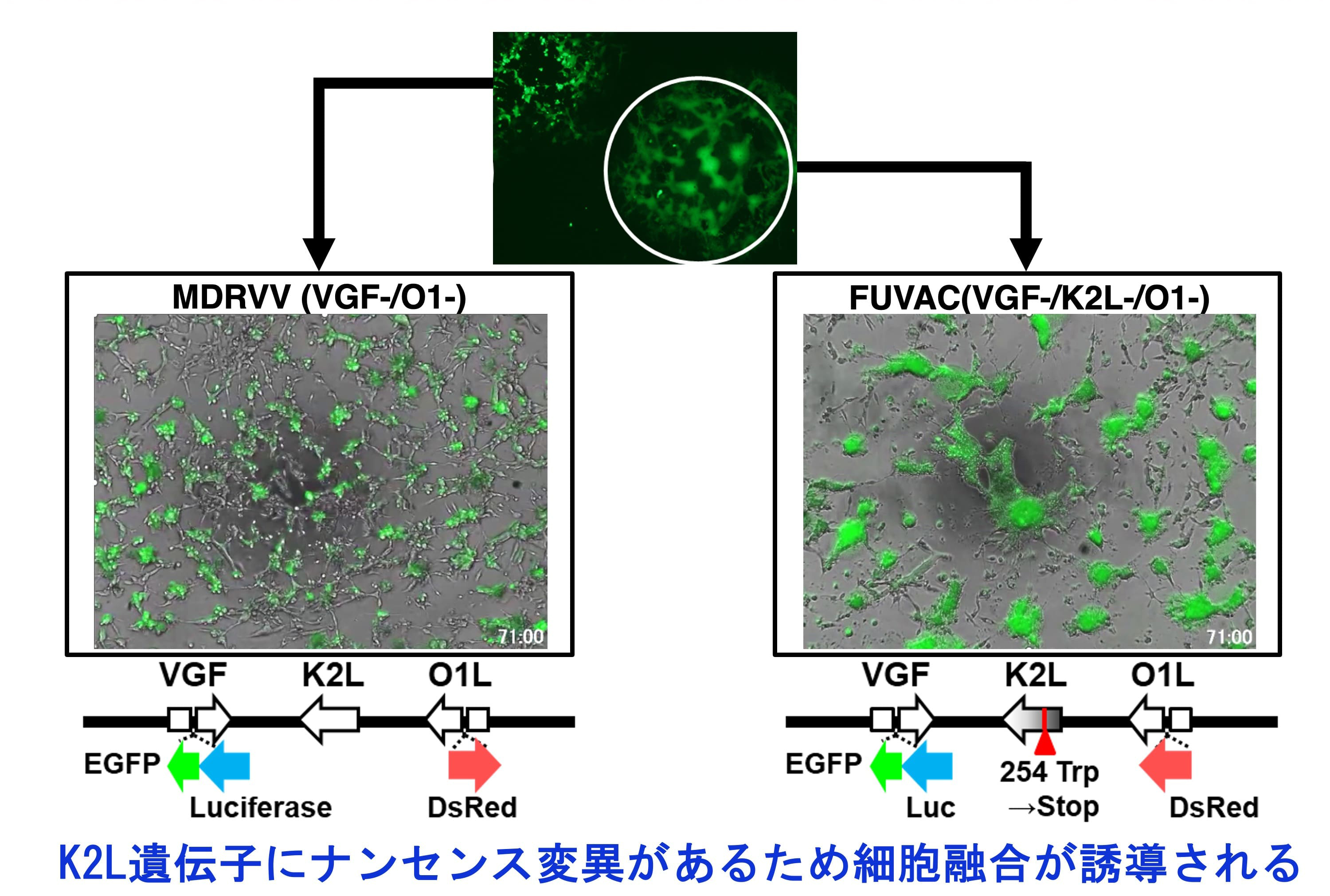
一方、上記のMDRVVを細胞中で複製させている際、通常では見られない細胞融合しながら増殖するウイルスを発見し、その単離に成功しました。単離されたウイルスは、全ゲノムシークエンス解析によってウイルスの持つK2L遺伝子にナンセンス変異が生じていることが判明し、Fusogenic Oncolytic Vaccinia Virus(FUVAC)と名付けました(図5)。
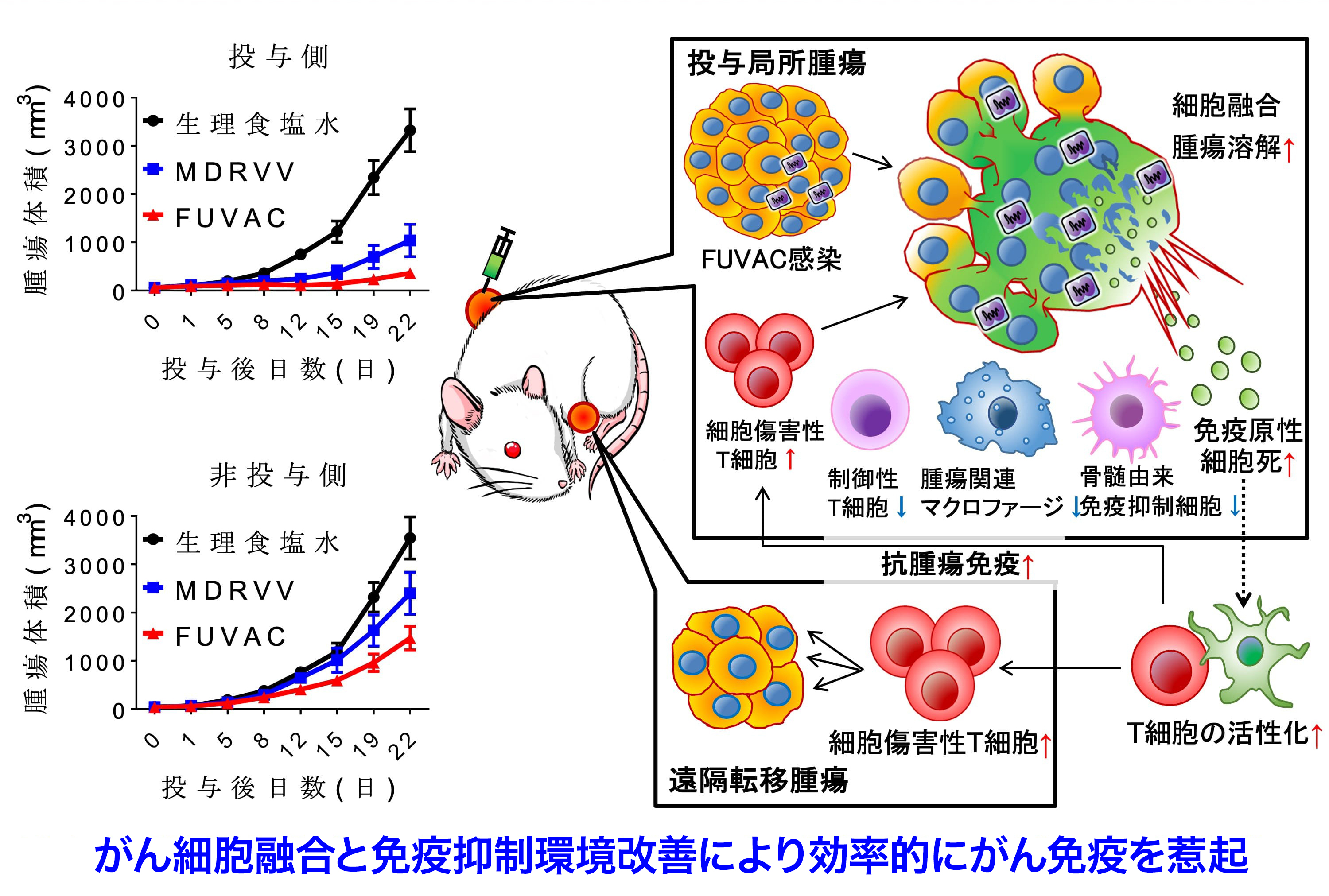
細胞融合を生じることなく増殖する従来のMDRVVと細胞融合を生じながら増殖するFUVACの抗がん効果を比較すべく、マウス大腸癌CT26細胞を両側の皮下に移植した担癌マウスモデルにおいて、各ウイルスを片側の腫瘍内にのみ投与しました。その結果、MDRVVを投与した局所の腫瘍(=原発巣)での治療効果は十分に得られるものの、MDRVVを投与しない遠隔の腫瘍(=転移巣)では十分な治療効果が得られないことが分かりました。それに対してFUVACは、投与側の腫瘍だけではなく非投与側の腫瘍に対しても、MDRVVと比べ有意な治療効果を発揮しました。組織学的および免疫学的解析によってFUVACの作用機序を詳細に調査したところ、1)ウイルスを投与した腫瘍内において細胞融合を引き起こすことで、広範な腫瘍溶解が生じ、2)それに続き抗腫瘍免疫応答を惹起しやすいと知られている免疫原性細胞死が誘導され、3)腫瘍内の制御性T細胞、腫瘍関連マクロファージや骨髄由来免疫抑制細胞が減少することで免疫抑制環境が改善されるとともに、4)ウイルスを投与した腫瘍だけではなく投与しない腫瘍への細胞傷害性T細胞の浸潤が高まることでより効果的に抗腫瘍免疫応答が賦活化されることを見出しました(図6)。
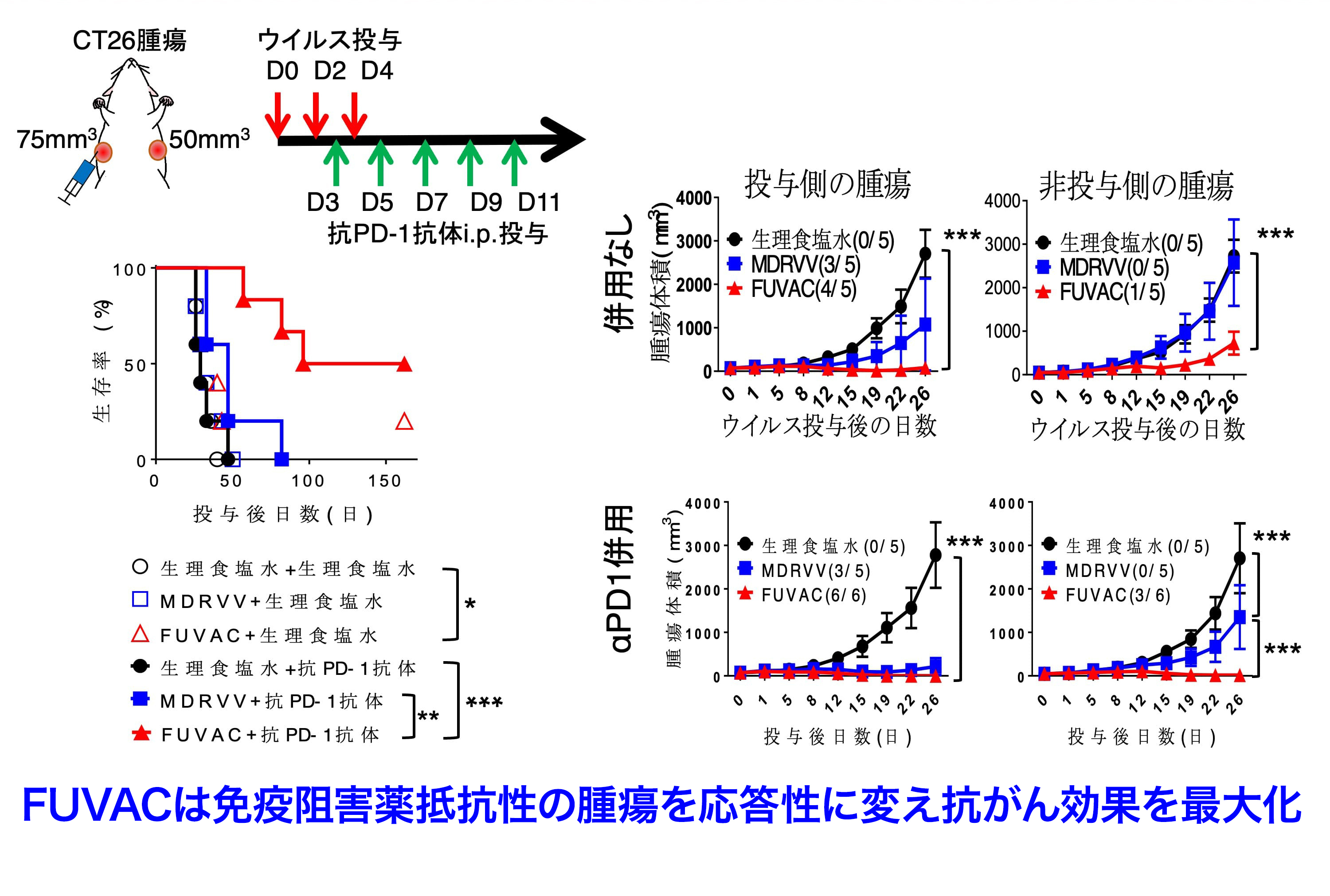
又、これらFUVACの作用機序は、抗腫瘍免疫応答のスタート役そしてアクセル役となるため、そのブレーキの解除役である免疫チェックポイント阻害剤との併用に適していることが示唆されました。そこで同様の担がんマウスモデルを用いてFUVACと抗PD-1抗体との併用を検討しました。その結果、MDRVVまたはFUVACの単独、およびMDRVVと抗PD-1抗体の併用では十分な治療効果が得られなかったのに対し、FUVACと抗PD-1抗体の併用では投与側腫瘍を完全に退縮させたのみでなく、半数のマウスで非投与側腫瘍も完治させるに至りました。抗PD-1抗体単独では治療効果が得られなかったことから、FUVACにより腫瘍内免疫環境が改善し、免疫チェックポイント阻害薬抵抗性の腫瘍を応答性に変えることで、抗がん効果をより効果的に最大化できることを実証しました(図7、Mol Ther 29:1782-1793, 2021)。