ユビキチン鎖による細胞機能制御の研究
極めて多くの細胞機能を制御するユビキチン鎖が、どのように健康な細胞を維持するのかを研究しています

私たちの体は、たくさんの細胞でできています。
この細胞が正常に働くためにはタンパク質が欠かせません。
タンパク質は約10万種類以上もあると考えられており、細胞の中でまるで小さな機械のように、さまざまな重要な仕事をしています。
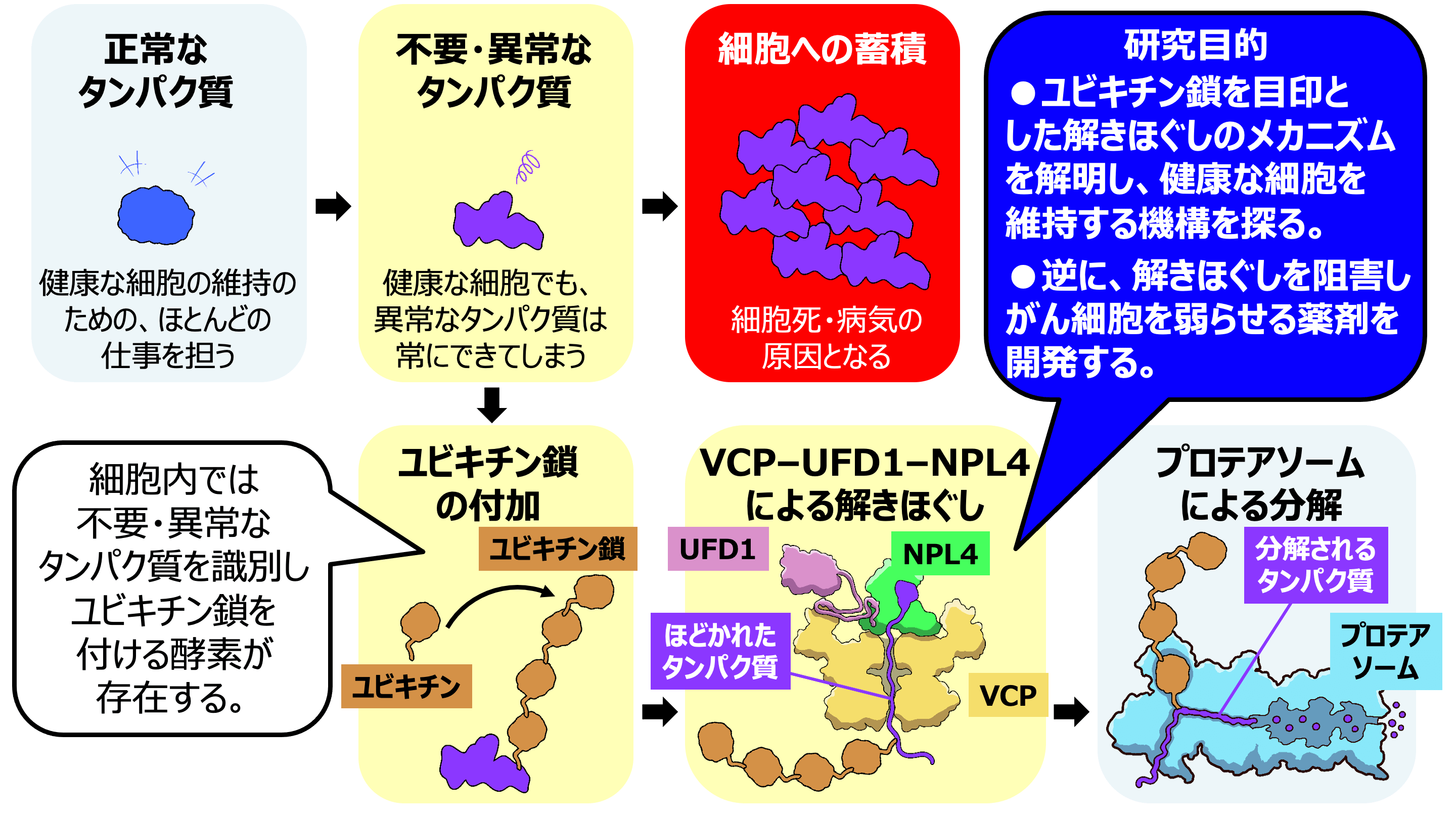
しかし、このタンパク質も仕事が終わって必要なくなったり、古くなって壊れたりすることがあります。
そんなタンパク質をそのままにしておくと、細胞の働きが悪くなってしまいます。
そこで活躍するのが、ユビキチンです。
ユビキチンはお互い次々と連結してユビキチン鎖を形成します。
不要になったり機能できなくなったりしたタンパク質には、このユビキチン鎖が分解の目印として付けられます。
多くの場合、ユビキチン鎖が付けられたタンパク質は、まずVCP (p97とも呼ばれる)、UFD1、NPL4という3種類のタンパク質によって解きほぐされます。
その後に、プロテアソームという巨大な酵素複合体によってバラバラに分解されます。
私たちは、この過程においてVCP–UFD1–NPL4がどのようにユビキチン鎖を捕まえてタンパク質を解きほぐすのかを詳しく研究しています。
この研究は、さまざまな病気の原因を解き明かすことにつながります。
たとえば、アルツハイマー病やパーキンソン病は、異常タンパク質が細胞の中にたまることで起こると考えられています。
VCP–UFD1–NPL4によるユビキチン鎖が付けられたタンパク質の分解の仕組みを理解することで、これらの病気の治療法や予防法を開発できる可能性があります。
一方、がん細胞は、とても速いスピードで増えるため、多くの不要なタンパク質も作ってしまいます。
このため、多くのがん細胞はタンパク質分解の働きが活発になっています。
この働きを阻害し、細胞内に不要なタンパク質を溜め込ませることでがん細胞を弱らせ、治療につながると考えられていています。
そこで、私たちはVCP–UFD1–NPL4の機能研究に加えて、その阻害方法も開発し、病気の治療に役立つ新しい薬や方法を開発することを目指しています。
さらに、ユビキチン鎖はその連結の仕方によって、タンパク質分解だけでなく、DNA修復や免疫反応など様々な機能を制御します。
私達はこのような連結の仕方の違いによって、なぜ機能が変わるのかについても研究を進め、ユビキチン鎖による細胞機能の制御メカニズムの全容解明を目指しています。
論文一覧
2026年
-
SPR interaction analysis of GM3 glycan with the integrin α5β1 head domain.
Hanashima S, Kishi M, Sasaki K, Sato Y, Murata M
Glycoconjugate journal
2026-01-06
DOI:
10.1007/s10719-025-10205-x
-
Advances in enzymatic reconstitution of ubiquitin chains and substrate ubiquitination
Yusuke Sato
The Journal of Biochemistry
2026-01-06
DOI:
10.1093/jb/mvaf086
2025年
-
ESCRT-I and PTPN23 mediate microautophagy of ubiquitylated tau aggregates
Yusen Men, Shoshiro Hirayama, Shinpei Ao, Yasuyuki Sakurai, Yuri Shibata, Megan Lo, Yusuke Sato, Shigeo Murata
Journal of Cell Biology
2025-06-02
DOI:
10.1083/jcb.202406120
-
Adaptor-Specific Peptide Inhibitors of the Ubiquitin-Chain-Dependent Unfolding Activity of the Human p97(VCP)–UFD1–NPL4 Complex
Kei Okatsu, Takaya Kawaguchi, Kohei Watanabe, Yoshinori Taguchi, Reon Takeuchi, Akinori Okamoto, Yasuyuki Iwasa, Takuya Tomita, Yasushi Saeki, Yusuke Sato, Tetsuo Narumi, Shuya Fukai
Journal of Medicinal Chemistry 68(11)
2025-05-27
DOI:
10.1021/acs.jmedchem.5c00201
-
Antitumor Activity of Vebreltinib and Characterization of Clinicogenomic Features in Solid Tumors with MET Rearrangements
Seshiru Nakazawa, Federica Pecci, Igor Odintsov, Dimitris Gazgalis, Felix H. Gottlieb, Biagio Ricciuti, Lodovica Zullo, Joao V. Alessi, Alessandro Di Federico, Mihaela Aldea, Edoardo Garbo, Malini M. Gandhi, Arushi Saini, William W. Feng, Jie Jiang, Simon Baldacci, Francesco Facchinetti, Maisam Makarem, Marie-Anaïs Locquet, Koji Haratani, Danielle Haradon, Benjamin Besse, Antoine Italiano, Jordi Remon, Pernelle Lavaud, Damien Vasseur, David Planchard, Yusuke Sato, Yukako Watanabe, Scott Owen, Alexis B. Cortot, Hoda Mahran, Martin D. Forster, Jiaxin Niu, Pascale Tomasini, Swan Swan Leong, Kevin Tay, Emilio Esteban, Anna Minchom, Sani H. Kizilbash, Marcia Cruz-Correa, Kin-Hung Peony Yu, Xiaoling Zhang, Pan Chen, Mythili Sangem, Jianwei Che, Lynette M. Sholl, Pasi A. Jänne, Mark M. Awad
Cancer Discovery
2025-05-14
DOI:
10.1158/2159-8290.cd-24-1726
-
Combinatorial ubiquitin code degrades deubiquitylation-protected substrates
Mai Morita, Miyu Takao, Honoka Tokuhisa, Ryotaro Chiba, Shota Tomomatsu, Yoshino Akizuki, Takuya Tomita, Akinori Endo, Yasushi Saeki, Yusuke Sato, Fumiaki Ohtake
Nature Communications 16(1)
2025-03-24
DOI:
10.1038/s41467-025-57873-9
2024年
-
Chemical Diversification of Enzymatically Assembled Polyubiquitin Chains to Decipher the Ubiquitin Codes Programmed on the Branch Structure
Takafumi Furuhata, Bumkyu Choi, Taiki Uno, Ryota Shinohara, Yusuke Sato, Kei Okatsu, Shuya Fukai, Akimitsu Okamoto
Journal of the American Chemical Society
2024-10-03
DOI:
10.1021/jacs.4c11279
-
The hypothetical molecular mechanism of the ethnic variations in the manifestation of age-related macular degeneration; focuses on the functions of the most significant susceptibility genes.
Shigeru Honda, Norihiko Misawa, Yusuke Sato, Daisuke Oikawa, Fuminori Tokunaga
Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie
2024-03-20
DOI:
10.1007/s00417-024-06442-9
-
Characterizing ATP processing by the AAA+ protein p97 at the atomic level
Mikhail Shein, Manuel Hitzenberger, Tat Cheung Cheng, Smruti R. Rout, Kira D. Leitl, Yusuke Sato, Martin Zacharias, Eri Sakata, Anne K. Schütz
Nature Chemistry
2024-03
DOI:
10.1038/s41557-024-01440-0
2023年
-
A strategy for orthogonal deubiquitination using a bump-and-hole approach
Takumi Suzuki, Yuki Utsugi, Satoshi Yamanaka, Hirotaka Takahashi, Yusuke Sato, Tatsuya Sawasaki, Yusaku Miyamae
RSC Chemical Biology 4(11)
2023-10-02
DOI:
10.1039/d3cb00095h
-
Involvement of heterologous ubiquitination including linear ubiquitination in Alzheimer's disease and amyotrophic lateral sclerosis.
Yusuke Sato, Seigo Terawaki, Daisuke Oikawa, Kouhei Shimizu, Yoshinori Okina, Hidefumi Ito, Fuminori Tokunaga
Frontiers in molecular biosciences 10
2023-01-16
DOI:
10.3389/fmolb.2023.1089213
-
Anammox Bacterial S-Adenosyl-l-Methionine Dependent Methyltransferase Crystal Structure and Its Interaction with Acyl Carrier Proteins.
Tesshin Uegaki, Taisei Takei, Shuhei Yamaguchi, Keisuke Fujiyama, Yusuke Sato, Tomoya Hino, Shingo Nagano
International journal of molecular sciences 24(1)
2023-01-01
DOI:
10.3390/ijms24010744
2022年
-
Spinocerebellar ataxia type 17-digenic TBP/STUB1 disease: neuropathologic features of an autopsied patient
Rie Saito, Yui Tada, Daisuke Oikawa, Yusuke Sato, Makiko Seto, Akira Satoh, Kodai Kume, Nozomi Ueki, Masahiro Nakashima, Shintaro Hayashi, Yasuko Toyoshima, Fuminori Tokunaga, Hideshi Kawakami, Akiyoshi Kakita
Acta Neuropathologica Communications 10(1)
2022-12-07
DOI:
10.1186/s40478-022-01486-6
-
Identification and molecular analysis of RNF31 Q622H germline polymorphism
Seshiru Nakazawa, Ryo Mamiya, Reika Kawabata‑Iwakawa, Daisuke Oikawa, Kyoichi Kaira, Fuminori Tokunaga, Sumihito Nobusawa, Yusuke Sato, Atsushi Sasaki, Toshiki Yajima, Ken Shirabe
Oncology Letters 24(5)
2022-09-21
DOI:
10.3892/ol.2022.13514
-
Structural Basis for the Prenylation Reaction of Carbazole‐Containing Natural Products Catalyzed by Squalene Synthase‐Like Enzymes
Ryuhei Nagata, Hironori Suemune, Masaya Kobayashi, Tetsuro Shinada, Kazuo Shin‐ya, Makoto Nishiyama, Tomoya Hino, Yusuke Sato, Tomohisa Kuzuyama, Shingo Nagano
Angewandte Chemie International Edition 61(20)
2022-05-09
DOI:
10.1002/anie.202117430
-
Structural basis for the linkage specificity of ubiquitin-binding domain and deubiquitinase
Yusuke Sato
The Journal of Biochemistry 172(1)
2022-04-08
DOI:
10.1093/jb/mvac031
-
Crystal structures of a 6-dimethylallyltryptophan synthase, IptA: Insights into substrate tolerance and enhancement of prenyltransferase activity
Hironori Suemune, Doukan Nishimura, Kenjiro Mizutani, Yusuke Sato, Tomoya Hino, Hiroshi Takagi, Yumi Shiozaki-Sato, Shunji Takahashi, Shingo Nagano
Biochemical and Biophysical Research Communications 593
2022-02
DOI:
10.1016/j.bbrc.2022.01.018


