- 氏名
佐藤 建三 - 【略歴】
1971年3月 大阪大学理学部生物学科卒業
1976年10月 九州大学大学院理学研究科生物学専攻博士課程修了 1976年11月 川崎医科大学生化学教室助手
1983年12月 米国シカゴ大学生化学分子生物学教室研究員
1990年4月 鳥取大学医学部生命科学科助教授(分子生物学教室) 1994年4月 同 教授 2003年4月 生命科学科長 (2007.3まで)
2009年4月 鳥取大学染色体工学研究センター(生命現象研究部門)教授兼任
実績・論文など
【発表論文】
Sasaki K, Taniguchi M, Miyoshi M, Goto O, Sato K, Watanabe T.: Are transcription factor (NF-kB and AP-1) involved in the angiotensin II-stimulated production of proinflammatory cytokines induced by LPS in dehydrated rats? Am J Physiol Regul Integr Comp Physiol 289: R1599–R1608, 2005.Taniguchi M, Hashimoto M, Hori N, and Sato K.: CCAAT/enhancer binding protein-β(C/EBP-β), a pivotal regulator of the TATA-less promoter in the rat catalase gene. FEBS-Letters 579: 5785- 5790, 2005
Watanabe K, Taniguchi M, Miyoshi M, Shimizu H, Imoto T, Sato K, Watanabe T.: Effects of central injection of angiotensin-converting-enzyme inhibitor and angiotensin type 1 receptor antagonist on the brain NF-kappaB and AP-1 activities of rats given LPS. Peptides. 27 1538 – 1546, 2006
Akihiro Maeda, Seiichi Nakamura, Masato Isono, Mitsuhiko Osaki, Hisao Ito and Kenzo Sato: Induction of efficient apoptosis and cell cycle arrest in tumor cells by adenovirus- mediated p53 A4 mutant. Pathol Int. 56(3):126-34 2006
Ryusuke Nakatsuka, Makoto Taniguchi, Mitsuhi Hirata, Goshi Shiota, and Kenzo Sato: Transient expression of bone morphogenic protein-2 in acute liver injury by carbon tetrachloride. J. Biochem, 141: 113-119, 2007
Haoran Wang, Mary X. Gao, Linda Li, Bin Wang, Naohiro Hori, Kenzo Sato: Isolation, expression, and characterization of the human ZCRB1 gene mapped to 12q12. Genomics 89: 59-69, 2007
Nozomi Tomimatsu, Candice T. Tahimic, Akihiro Otsuki, Sandeep Burma, Akiko Fukuhara, Kenzo Sato, Goshi Shiota, Mitsuo Oshimura, David J. Chen, and Akihiro Kurimasa.Ku70/80 modulates ATM and ATR signaling pathways in response to DNA double strand breaks. J. Biol. Chem. 282: 10138-1045, 2007.
M. Hashimoto, M. Taniguchi, S. Yoshino, S. Arai, K. Sato.: S phase-preferential Cre-recombination in mammalian cells revealed by HIV-TAT-PTD-mediated protein transduction. J. Biochem. 143, 87–95, 2008
Nagahama Y., Ishimaru M., Osaki M., Inoue A., Maeda A., Nakada C., Moriyama M., Sato K., Oshimra M., Ito H.: Apoptotic pathway induced by transduction of RUNX3 in the human gastric carcinoma cell line MKN-1. Cancer Science 99: 23-30, 2008
Mitsuhi Hirata, Kumiko Amano, Ayumi Miyashita, Mayu Yasunaga,Tomoko Nakanishi and Kenzo Sato: Establishment and characterization of hepatic stem-like cell lines from normal adult rat liver. J. Biochem. 145: 51–58, 2009
遺伝子のはたらきを光に変えて
2008年のノーベル化学賞は緑色蛍光タンパク質を発見した下村脩博士と、応用技術を開発したマーチン・シャルフィー教授とロジャー・チェン教授に贈られました。この技術により蛍光タンパク質を発現する細胞をマークし追跡するだけでなく、特定のタンパク質の生体内や細胞内での分布や生成過程を可視化することができるようになりました。見えないものを見えるようにする技術は、医学の分野において、とくに基礎研究や医療技術開発研究において、計り知れない莫大な威力を示しました。我々は染色体上における遺伝子の働きを、蛍光(発光)タンパク質の産生量に置き換えて、観察するシステムを構築しました。
【細胞が光る】
生物が光を発するしくみには2通りが知られています。1つは今回ノーベル賞の対象となった緑色蛍光タンパク質で、このタンパク質に短い波長の光が当たると、タンパク質自体が励起され、可視光を放ちます。励起光が止まると蛍光も止まります。もうひとつはホタルの光で、発光基質を酵素的に酸化還元反応などで活性化すると発光基質が光ります。このときの酵素がなくなったり、発光基質がなくなると光も止まります。したがって、蛍光タンパク質やルシフェラーゼのような発光関連酵素を細胞の中で発現させると細胞が光るようになりますが、それぞれの特徴から利用方法と測定方法が異なってきます。
【遺伝子発現を光に変える】
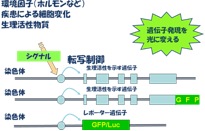 ヒトゲノムには約2万5000個のタンパク質を作ることができる遺伝子が知られていますが、すべての遺伝子が一様に働いているのではありません。発生過程では細胞を分化させたり形態形成に関わる遺伝子などが発現しおり、大人になってもそれぞれの臓器や器官、細胞で異なる遺伝子が使われています。食事や睡眠、運動、病気など様々な環境の変化に応じて、遺伝子はスイッチが入ったり切れたり絶え間なく調節されています。我々はこの遺伝子の働きを観察するために、図のように遺伝子発現の調節領域にルシフェラーゼ遺伝子を連結し、ヒト人工染色体ベクター(HAC)に組み込み、細胞内に導入しました。この細胞をもとにマウス個体を作成し、どのような臓器がどのような条件下で光るかを、in vivoイメージングという方法で解析しました。ここでは2つの遺伝子、骨の形成と膵臓機能に関わる遺伝子の働きについて紹介します。
ヒトゲノムには約2万5000個のタンパク質を作ることができる遺伝子が知られていますが、すべての遺伝子が一様に働いているのではありません。発生過程では細胞を分化させたり形態形成に関わる遺伝子などが発現しおり、大人になってもそれぞれの臓器や器官、細胞で異なる遺伝子が使われています。食事や睡眠、運動、病気など様々な環境の変化に応じて、遺伝子はスイッチが入ったり切れたり絶え間なく調節されています。我々はこの遺伝子の働きを観察するために、図のように遺伝子発現の調節領域にルシフェラーゼ遺伝子を連結し、ヒト人工染色体ベクター(HAC)に組み込み、細胞内に導入しました。この細胞をもとにマウス個体を作成し、どのような臓器がどのような条件下で光るかを、in vivoイメージングという方法で解析しました。ここでは2つの遺伝子、骨の形成と膵臓機能に関わる遺伝子の働きについて紹介します。
【骨形成を可視化】
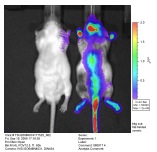 骨は絶えず分解と合成が繰り返され、数ヶ月でまったく新しい骨に生まれ変わっています。破骨細胞は古くなった骨を分解し、骨芽細胞は骨の成分を合成・分泌します。骨の主成分のコラーゲンとカルシウム(ハイドロキシアパタイト)が合わさって強固な骨が形成されますが、この骨の形成を生きたままで観察するために、骨芽細胞のみが産生・分泌するオステオカルシン遺伝子の発現レベルに注目しました。そこでオステオカルシン遺伝子発現調節領域とルシフェラーゼ遺伝子を連結し、HACを作成し、胚操作を行ってキメラマウスを作りました。4週齢のHACキメラマウスに発光基質のルシフェリンを注射し、高感度カメラで撮影すると、頭蓋骨や背骨、手足の骨、尾が光ります。生まれたては骨形成が盛んなので強く光りますが、生後12週(人でいえば40歳くらい)となると骨形成はかなり低下しています。このようなマウスにビタミンDを飲ませると、数百倍に遺伝子発現が上昇します。このマウスは生きたままで遺伝子発現の様子を私たちに教えてくれます。骨粗鬆症をはじめ様々な骨の病気の治療法や医薬・食品の開発に役に立ちます。
骨は絶えず分解と合成が繰り返され、数ヶ月でまったく新しい骨に生まれ変わっています。破骨細胞は古くなった骨を分解し、骨芽細胞は骨の成分を合成・分泌します。骨の主成分のコラーゲンとカルシウム(ハイドロキシアパタイト)が合わさって強固な骨が形成されますが、この骨の形成を生きたままで観察するために、骨芽細胞のみが産生・分泌するオステオカルシン遺伝子の発現レベルに注目しました。そこでオステオカルシン遺伝子発現調節領域とルシフェラーゼ遺伝子を連結し、HACを作成し、胚操作を行ってキメラマウスを作りました。4週齢のHACキメラマウスに発光基質のルシフェリンを注射し、高感度カメラで撮影すると、頭蓋骨や背骨、手足の骨、尾が光ります。生まれたては骨形成が盛んなので強く光りますが、生後12週(人でいえば40歳くらい)となると骨形成はかなり低下しています。このようなマウスにビタミンDを飲ませると、数百倍に遺伝子発現が上昇します。このマウスは生きたままで遺伝子発現の様子を私たちに教えてくれます。骨粗鬆症をはじめ様々な骨の病気の治療法や医薬・食品の開発に役に立ちます。
【膵臓機能を光で観察】
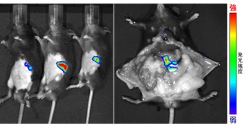 膵臓は生体内のエネルギーバランスを調節する重要な器官ですが、その機能を生きたまま観察しようと試みています。膵臓で特異的な遺伝子の発現調節領域にルシフェラーゼ遺伝子を連結し、トランスジェニックマウスを作成しました。3系統のマウスが作製されましたが、いずれも膵臓が光っています。面白いことに、この光の強さはマウスを半日絶食させると強くくなります。また、朝昼夜とで光の強さは変化します。これは膵臓の機能が様々な環境の変化を受けて、その機能を調節していることと一致します。本来、哺乳動物は餌のとれない飢餓と絶えず直面していました。このような野生の時期に獲得した膵臓機能の調節の仕組みは、現在の飽食の時代には肥満や糖尿病などの様々な病気の原因ともなっています。
膵臓は生体内のエネルギーバランスを調節する重要な器官ですが、その機能を生きたまま観察しようと試みています。膵臓で特異的な遺伝子の発現調節領域にルシフェラーゼ遺伝子を連結し、トランスジェニックマウスを作成しました。3系統のマウスが作製されましたが、いずれも膵臓が光っています。面白いことに、この光の強さはマウスを半日絶食させると強くくなります。また、朝昼夜とで光の強さは変化します。これは膵臓の機能が様々な環境の変化を受けて、その機能を調節していることと一致します。本来、哺乳動物は餌のとれない飢餓と絶えず直面していました。このような野生の時期に獲得した膵臓機能の調節の仕組みは、現在の飽食の時代には肥満や糖尿病などの様々な病気の原因ともなっています。
【生きたままで生理機能を観察】
現在、様々なヒトの病気に対するモデル動物が作製されています。この動物はヒトに代わって病気のしくみを解明し、治療技術の開発にとても役立っています。しかし、病気の治癒過程など時間的変化をみる場合、多くのモデル動物が各時間毎に解析されることになります。もし生きたままでそれぞれの臓器の生理的状態を観察できれば、個体差を考えることなく時間経過を追跡することができます。このように、in vivoイメージング技術は、動物に優しく、精度の高い研究方法といえます。これらのマウスによって、治療薬の効果の確認や食品の機能性、生活環境の影響など医療における技術開発とともに、そのしくみを解明する基礎研究への応用が期待されています。
