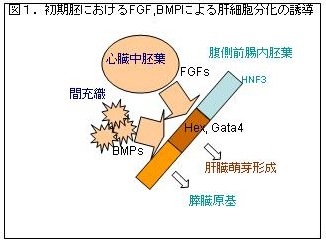
近年、C型肝炎ウイルスの活性化や薬物摂取による肝炎、肝硬変、肝癌による死亡者数が増加傾向にあり、その発症メカニズムの解明や治療法の開発は社会的急務となっている。 一方、初期胚における肝臓形成の過程で、腹側前腸内胚葉が心臓中胚葉や間充織細胞からの骨形成因子(BMP-4)やFGF-2刺激によって増殖分化し、肝原基の形成に導かれていることが明らかにされている(Duncan SA, Gene Dev 15:1879-1884, 2001)。腹側内胚葉はHexやGATA4などの転写因子の発現が特徴的であり、この内因性の分化プログラムと中胚葉からの外因性の刺激によって肝臓形成が達成されている(図1)。
肝障害における再生シグナル誘導の研究に関して、我々はこれまでに次の点を明らかにし、この研究における基礎的な知識と技術的な基盤を高めることができた。①四塩化炭素肝障害初期過程において、肝再生シグナルが始動していることをNF-kBおよびErkシグナルの一過性の活性化によって明らかにした (Life Sci. 75:1539-1549, 2004)。②肝障害初期過程で一過性にBMP-2をはじめFGF-2、Hexなどの発現を観察した(J. Biochem 141:113-119, 2007)。これらのサイトカインや転写因子は動物初期胚における肝臓の形態形成過程で重要な役割を果たすものである。すなわち、肝障害におけるマクロファージや単核球由来細胞などの活性化は肝細胞の損傷の誘導とともに、一方ではBMPなどのサイトカインを介した肝細胞分化誘導シグナルが未分化型肝細胞の分化・成熟に関与する可能性を示唆するものであった。このような初期胚で活性化された肝細胞増殖分化のシグナルが、成体での薬物肝障害の修復過程においても利用されるという観点から、肝細胞損傷の修復過程の研究を試みた例はこれまでに世界中にない初めての試みである。この肝再生シグナルの制御のメカニズムの解明は、肝障害からの治療をめざして、有益な基礎知識となることが期待される。 我々はこれまでにつぎのことを明らかにし、研究の基盤を作り出した。肝線維症モデルラットに尾静脈よりアデノウイルスベクターを導入すると、線維隔壁内の線維芽細胞を中心にin vivo 遺伝子導入が可能である(J. Hepatol. 30:101, 1999)。アデノウイルスの線維芽細胞への感染効率の改善はファイバーに変異を入れることによって達成できる(Hum. Gene Ther. 13:613, 2002, J. Virol. 77:2512, 2003)。肝星細胞の活性化や線維化の進行に関わるTGF-b活性を抑制するLAP(latency-associated peptide)遺伝子をアデノウイルスベクターにより導入することで、筋線維芽細胞を逆分化させることができた(B.B.R.C. 311:959-965, 2003)。また、四塩化炭素による成熟肝細胞および肝前駆細胞の増殖分化誘導・損傷修復系のほか、レトロルシン/四塩化炭素処理による骨髄性幹細胞や肝幹細胞の活性化の現象が知られている。この2つの肝臓障害・修復系に注目する。 本研究においては、肝障害初期過程で一過性に誘導されるBMP-2が、肝細胞損傷の修復過程で重要な役割を果たしていると考え、①BMPsが肝臓内のどの細胞種により、どのようなメカニズムで産生され、②未分化型肝細胞の分化・成熟にどのように関与しているのかどうかを、BMP受容体のコンディショナル・ノックアウト・モデル動物およびBMPs発現レポーター・トランスジェニックマウスを用いて分子生物学的手法により解析する。また試験管内での損傷-修復モデル系を構築しサイトカインなど損傷細胞に由来する再生誘導シグナルを同定し、肝細胞損傷の修復過程を解明することをめざしている。 |